题目内容
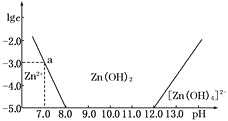
【题目】如下图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.
回答下列问题:
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为_______________。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=____________________。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是__________________。
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表:
c(HCl) | |||||||
(mol/L) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
103c(PbCl2) | |||||||
(mol/L) | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 14.01 |
根据上表数据判断下列说法正确的是________。
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大 |
B.PbCl2固体在0.50 mol/L盐酸中的溶解度小于在纯水中的溶解度 |
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子) |
D.PbCl2固体可溶于饱和食盐水 |
【答案】Zn2++4OH-===[Zn(OH)4]2- 10-17 8.0<pH<12.0 A、B、C、D
【解析】
(1)根据图像可知,往ZnCl2溶液中加入足量的氢氧化钠溶液生成[Zn(OH)4]2-,反应的离子方程式可表示为Zn2++4OH-===[Zn(OH)4]2-;
(2)根据图中数据a点可知,c(Zn2+)=10-3时c(OH-)=10-7,溶度积Ksp[Zn(OH)2]=c(Zn2+)×c2(OH-)=10-3×(10-7)2=10-17;
(3)根据图像可知,pH在8~12之间时以Zn(OH)2的形式存在,生成氢氧化锌沉淀可以提取Zn2+,所以控制溶液中pH的范围是8.0<pH<12.0;
(4)A、根据上表数据,盐酸浓度为1mol/L时,PbCl2的溶解度最小,随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大,故A正确;
B、PbCl2固体存在沉淀溶解平衡,加少量Cl-平衡逆移,氯离子浓度越大, PbCl2的溶解度越小,故B正确;
C、PbCl2在浓盐酸中溶解度增大,说明生成了配合物,所以PbCl2能与浓盐酸反应生成一种难电离的阴离子,故C正确;
D、PbCl2可与Cl-形成配离子,所以PbCl2固体可溶于饱和食盐水,故D正确。

【题目】下表给出了五种元素的相关信息,其中![]() 、
、![]() 、
、![]() 、
、![]() 为短周期元素。
为短周期元素。
元素 | 相关信息 |
| 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| 工业上通过分离液态空气获得它的一种单质,含它的另一种单质的浓度相对较高的平流层是保护地球地表环境的重要屏障 |
| 植物生长所需的主要元素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| 室温下其单质为粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| 它是人体不可缺少的微量元素,含该元素的合金是工业生产中不可缺少的金属材料,常用于建造桥梁、楼房等 |
根据上述信息填空:
(1)![]() 元素的原子含有________个能层,其中第二能层中的能级包括_________;画出
元素的原子含有________个能层,其中第二能层中的能级包括_________;画出![]() 的原子结构示意图:________________。
的原子结构示意图:________________。
(2)![]() 与
与![]() 形成的某种化合物能和
形成的某种化合物能和![]() 与
与![]() 形成的另一种无色化合物(这两种化合物分子中
形成的另一种无色化合物(这两种化合物分子中![]() 与另一元素原子的个数比均为
与另一元素原子的个数比均为![]() )一起用作火箭推进剂,写出二者发生反应生成无毒物质的化学方程式:__________________________________。
)一起用作火箭推进剂,写出二者发生反应生成无毒物质的化学方程式:__________________________________。
(3)某矿藏主要含![]() 、
、![]() 两种元素组成的化合物,它是我国生产某强酸的主要原料。试写出生产该强酸过程中第一阶段主要反应的化学方程式:________。
两种元素组成的化合物,它是我国生产某强酸的主要原料。试写出生产该强酸过程中第一阶段主要反应的化学方程式:________。
【题目】工业上可用隔膜电解槽电解食盐水的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,如次氯酸钠等。根据题意完成下列计算:
(1)某氯碱厂测得某组电解槽的阳极每小时产生气体485.92m3(折算到标准状况,下同),合________________mol;测知其中Cl2的体积分数为0.985(杂质为O2),则该气体的密度为________________;阴极产生NaOH_________mol(保留四位有效数字,下同)。
(2)下表提供了两极溶液浓度的变化数据(阴阳两个极区的物料不流通,忽略其中溶液的体积变化)。
阴极:NaOH溶液质量分数 | 阳极:NaCl溶液浓度(g/L) | |
进料液 | 0.30 | 310 |
电解后 | 0.32 | 210 |
若某个电解槽每小时进NaOH溶液52.000 kg,得到碱溶液初产品90.416 kg,则阳极区每小时加入NaCl溶液_______________m3。取碱溶液初产品中的40% 加入一定量纯水,达到阴极进料液的浓度要求,则需要加入纯水_________________L。
(3)产品之一----漂水(NaClO溶液)具有良好的消毒、漂白能力。在制漂水过程中取1L溶液,测得pH=12(忽略水解),NaClO含量为0.3725g。在一定条件下,将该溶液制成晶体,质量最多为1.335g。通过列式计算,写出该晶体的化学式_________________。