题目内容
【题目】有机物![]() 只含有
只含有![]() 、
、![]() 、
、![]() 三种元素,常用作有机合成的中间体。
三种元素,常用作有机合成的中间体。![]() 该有机物在足量
该有机物在足量![]() 中充分燃烧生成
中充分燃烧生成![]()
![]() 和
和![]()
![]() ,质谱图表明其相对分子质量为84,分析其红外光谱图可知
,质谱图表明其相对分子质量为84,分析其红外光谱图可知![]() 分子中含有
分子中含有![]() 键和位于端点处的
键和位于端点处的![]() 键,核磁共振氢谱上有三组峰,峰面积之比为
键,核磁共振氢谱上有三组峰,峰面积之比为![]() 。
。
(1)![]() 的分子式是______。
的分子式是______。
(2)![]() 的结构简式是______。
的结构简式是______。
(3)下列物质中,一定条件下能与![]() 发生反应的是______(填序号)。
发生反应的是______(填序号)。
A.![]() B.
B.![]()
C.酸性![]() 溶液 D.
溶液 D.![]() 的
的![]() 溶液
溶液
(4)有机物![]() 是
是![]() 的同分异构体,
的同分异构体,![]()
![]() 最多可与
最多可与![]()
![]() 完全加成。已知
完全加成。已知![]() 中所有碳原子在同一个平面上,且没有顺反异构现象,则
中所有碳原子在同一个平面上,且没有顺反异构现象,则![]() 的结构简式为______。
的结构简式为______。
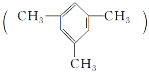
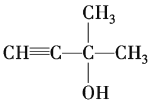
【答案】![]()
 ABCD
ABCD 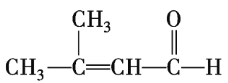
【解析】
根据有机物燃烧法计算元素原子比例,核磁共振氢谱显示有机物中氢环境有3种,峰面积表示同环境氢原子的个数,据此回答问题。
![]() 该有机物相对分子质量为84,在足量
该有机物相对分子质量为84,在足量![]() 中充分燃烧生成
中充分燃烧生成![]()
![]() 和
和![]()
![]() ,即n(有机物):n(C原子):n(H原子)=
,即n(有机物):n(C原子):n(H原子)=![]() =1:5:8;根据物质相对原子质量可知,分子中含有1个氧原子,即分子式为C5H8O;其红外光谱图可知,
=1:5:8;根据物质相对原子质量可知,分子中含有1个氧原子,即分子式为C5H8O;其红外光谱图可知,![]() 分子中含有
分子中含有![]() 键和位于端点处的
键和位于端点处的![]() 键,核磁共振氢谱上有三组峰,峰面积之比为
键,核磁共振氢谱上有三组峰,峰面积之比为![]() ,即结构中含有2个甲基,结构简式为
,即结构中含有2个甲基,结构简式为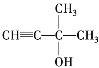 。
。
(1)据以上分析可知:![]() 的分子式是C5H8O;
的分子式是C5H8O;
(2)![]() 的结构简式是
的结构简式是 ;
;
(3)有机物A中官能团结构有碳碳三键,羟基,故能发生氢气和液溴的加成反应,与酸性高锰酸钾的氧化反应,与单质钠发生的置换反应,答案为ABCD。
(4)有机物![]() 是
是![]() 的同分异构体,
的同分异构体,![]()
![]() 最多可与
最多可与![]()
![]() 完全加成,即只含有一个不饱和碳碳双键。已知
完全加成,即只含有一个不饱和碳碳双键。已知![]() 中所有碳原子在同一个平面上,且没有顺反异构现象,则B的含氧官能团为醛基,
中所有碳原子在同一个平面上,且没有顺反异构现象,则B的含氧官能团为醛基,![]() 的结构简式为
的结构简式为![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】工业上可用隔膜电解槽电解食盐水的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,如次氯酸钠等。根据题意完成下列计算:
(1)某氯碱厂测得某组电解槽的阳极每小时产生气体485.92m3(折算到标准状况,下同),合________________mol;测知其中Cl2的体积分数为0.985(杂质为O2),则该气体的密度为________________;阴极产生NaOH_________mol(保留四位有效数字,下同)。
(2)下表提供了两极溶液浓度的变化数据(阴阳两个极区的物料不流通,忽略其中溶液的体积变化)。
阴极:NaOH溶液质量分数 | 阳极:NaCl溶液浓度(g/L) | |
进料液 | 0.30 | 310 |
电解后 | 0.32 | 210 |
若某个电解槽每小时进NaOH溶液52.000 kg,得到碱溶液初产品90.416 kg,则阳极区每小时加入NaCl溶液_______________m3。取碱溶液初产品中的40% 加入一定量纯水,达到阴极进料液的浓度要求,则需要加入纯水_________________L。
(3)产品之一----漂水(NaClO溶液)具有良好的消毒、漂白能力。在制漂水过程中取1L溶液,测得pH=12(忽略水解),NaClO含量为0.3725g。在一定条件下,将该溶液制成晶体,质量最多为1.335g。通过列式计算,写出该晶体的化学式_________________。
【题目】下表列出了元素周期表中前20号元素中某些元素性质的一些数据:
性质元素 | 原子半径( | 最高价态 | 最低价态 |
① | 1.02 |
|
|
② | 2.27 |
| — |
③ | 0.74 | — |
|
④ | 1.43 |
| — |
⑤ | 0.77 |
|
|
⑥ | 1.10 |
|
|
⑦ | 0.99 |
|
|
⑧ | 1.86 |
| — |
⑨ | 0.75 |
|
|
⑩ | 1.17 |
|
|
试回答下列问题。
(1)以上10种元素中,第一电离能最小的是______(填序号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的物质有______(填分子式,两种即可)。元素⑨和⑩形成的化合物的化学式为______;元素①的原子价电子排布式是______。
(3)①、⑥、⑦、⑩四种元素的简单氢化物的稳定性由强到弱的顺序是______(填化学式)。
(4)③和⑨两元素相比,非金属性较弱的是______(填名称),可以验证该结论的是______(填序号)。
A.气态氢化物的挥发性
B.单质分子中的键能
C.两元素的电负性
D.含氧酸的酸性
E.最简单氢化物的稳定性
F.两单质在自然界中的存在形式
【题目】某研究小组将纯净的SO2气体通入0.1molL﹣1的Ba(NO3)2溶液中,得到了BaSO4沉淀。为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2;
(1)验证假设一
该小组设计实验验证了假设一,请在下表空白处填写相关实验现象.
实验步骤 | 实验现象 | 结论 |
实验1:在盛有不含O2的25mL0.1molL﹣1BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | _______ | 假设一成立 |
实验2:在盛有不含O2的25mL0.1molL﹣1Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 | ________ |
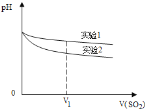
为深入研究该反应,该小组还测得上述两个实验中溶液pH随通入SO2体积的变化曲线如图。实验1中溶液pH变小的原因是____________;V1时,实验2中溶液pH小于实验1的原因是__________。(用离子方程式表示)
(2)验证假设二
请设计实验验证假设二,写出实验步骤、预期现象和结论:
实验步骤 | 实验现象 | 结论 |
__________________ | ______________ | 假设二成立 |
(3)若假设二成立,请预测:在相同条件下,分别用足量的O2和KNO3氧化相同的H2SO3溶液(溶液体积变化忽略不计),充分反应后两溶液的pH前者_____________(填“大于”或“小于”)后者,理由是__________________________。