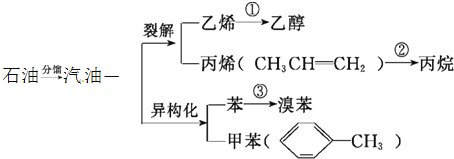
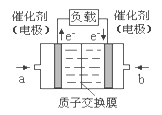
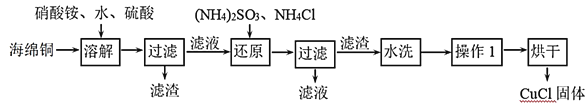
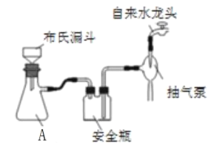
题目内容
【题目】X、Y、Z代表三种元素。已知:①![]() 和
和![]() 两种离子具有相同的电子层结构;②Z元素原子核内质子数比Y元素原子核内质子数少9;③Y和Z两种元素可以形成4核42电子的
两种离子具有相同的电子层结构;②Z元素原子核内质子数比Y元素原子核内质子数少9;③Y和Z两种元素可以形成4核42电子的![]() 价阴离子。
价阴离子。
(1)Y元素是______(填元素符号,下同),其原子的核外电子排布式为______,Z元素是______,其原子结构示意图为______
(2)由X、Y、Z三种元素形成的含68个电子的盐类化合物的化学式是______
【答案】Cl ![]() O
O 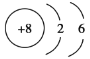
![]()
【解析】
Z元素原子核内质子数比Y元素原子核内质子数少9,可以设Z元素的核电荷数为z,则Y元素的核电荷数为z+9,Y和Z两种元素可以形成4核42电子的![]() 价阴离子,若Y和Z两种元素形成的
价阴离子,若Y和Z两种元素形成的![]() 价阴离子为Y3Z-,则3(z+9)+z=42-1,解得z=3.5,不合题意,舍去;若Y和Z两种元素形成的
价阴离子为Y3Z-,则3(z+9)+z=42-1,解得z=3.5,不合题意,舍去;若Y和Z两种元素形成的![]() 价阴离子为Y2Z2-,则2(z+9)+2z=42-1,解得z=5.75,不合题意,舍去;若Y和Z两种元素形成的-1价阴离子为YZ3-,则z+9+3z=42-1,解得z=8,则Z为O,Y为Cl。
价阴离子为Y2Z2-,则2(z+9)+2z=42-1,解得z=5.75,不合题意,舍去;若Y和Z两种元素形成的-1价阴离子为YZ3-,则z+9+3z=42-1,解得z=8,则Z为O,Y为Cl。![]() 和
和![]() 两种离子具有相同的电子层结构,所以X为K。
两种离子具有相同的电子层结构,所以X为K。
(1)根据以上分析,Y元素是Cl,其原子的核外电子排布式为![]() ,Z元素是O,其原子结构示意图为
,Z元素是O,其原子结构示意图为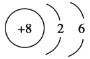 ;
;
(2)Cl形成的含氧酸盐中有1个Cl,1个K,可以计算出有4个O,所以化学式是![]() 。
。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】某研究小组将纯净的SO2气体通入0.1molL﹣1的Ba(NO3)2溶液中,得到了BaSO4沉淀。为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2;
(1)验证假设一
该小组设计实验验证了假设一,请在下表空白处填写相关实验现象.
实验步骤 | 实验现象 | 结论 |
实验1:在盛有不含O2的25mL0.1molL﹣1BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | _______ | 假设一成立 |
实验2:在盛有不含O2的25mL0.1molL﹣1Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 | ________ |
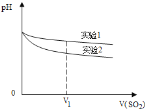
为深入研究该反应,该小组还测得上述两个实验中溶液pH随通入SO2体积的变化曲线如图。实验1中溶液pH变小的原因是____________;V1时,实验2中溶液pH小于实验1的原因是__________。(用离子方程式表示)
(2)验证假设二
请设计实验验证假设二,写出实验步骤、预期现象和结论:
实验步骤 | 实验现象 | 结论 |
__________________ | ______________ | 假设二成立 |
(3)若假设二成立,请预测:在相同条件下,分别用足量的O2和KNO3氧化相同的H2SO3溶液(溶液体积变化忽略不计),充分反应后两溶液的pH前者_____________(填“大于”或“小于”)后者,理由是__________________________。