题目内容
2.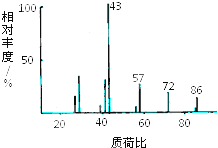 某有机物含有C、H、O三种元素,其质谱如图所示.将4.3g该有机物在O2中充分燃烧,使生成物依次通过足量浓硫酸和碱石灰,浓硫酸增重2.7g,碱石灰增重8.8g,则:
某有机物含有C、H、O三种元素,其质谱如图所示.将4.3g该有机物在O2中充分燃烧,使生成物依次通过足量浓硫酸和碱石灰,浓硫酸增重2.7g,碱石灰增重8.8g,则:(1)该有机物的摩尔质量为86g/mol.
(2)该有机物的分子式为C4H6O2.
(3)1mol该有机物与足量的金属钠反应产生1mol氢气,核磁共振氢谱有两个峰,且面积比为2:1,请写出其结构简式HOCH2C≡CCH2OH.
分析 (1)根据质谱图中数据判断该有机物的相对分子量;
(2)根据有机物燃烧生成的二氧化碳和水的物质的量求C、H的物质的量和质量,再求出氧元素的物质的量,然后计算出C、H、O元素的物质的量之比,从而得出其实验式,再根据其相对分子量计算出其分子式;
(3)1mol该有机物与足量的金属钠反应产生1mol氢气,则分子中含有2个-OH,核磁共振氢谱有两个峰,且面积比为2:1,则含有2种环境的氢原子,而且氢原子数目之比为2:1,结合其分子式分析.
解答 解:(1)根据质谱图可知,该有机物的相对分子质量为86,则其摩尔质量为86g/mol;
故答案为:86;
(2)浓硫酸增重2.7g,则生成水的质量为2.7g,所以n(H)=2n(H2O)=2×$\frac{2.7g}{18g/mol}$=0.3mol,碱石灰增重8.8g,则n(C)=n(CO2)=$\frac{8.8g}{44g/mol}$=0.2mol,
则该有机物中O元素的质量为4.3g-0.3mol×1g/mol-0.2mol×12g/mol=1.6g,则n(O)=$\frac{1.6g}{16g/mol}$=0.1mol,
则该物质中碳、氢、氧原子个数之比=0.2:0.3:0.1=2:3:1,所以其实验式为:C2H3O,该有机物的相对分子质量为86,则该有机物的分子式是C4H6O2,
故答案为:C4H6O2;
(3)已知该有机物的分子式为C4H6O2,1mol该有机物与足量的金属钠反应产生1mol氢气,则分子中含有2个-OH,核磁共振氢谱有两个峰,且面积比为2:1,则含有2种环境的氢原子,而且氢原子数目之比为2:1,说明该分子结构对称,与饱和烃的衍生物相比较少4个H,则分子中含有1个三键,其结构简式为:HOCH2C≡CCH2OH;
故答案为:HOCH2C≡CCH2OH.
点评 本题考查了有机物实验式、分子式的确定,题目难度中等,注意掌握有机物分子式的计算方法,明确质谱图的含义,能够根据质谱图判断物质的相对分子量以及根据核磁共振氢谱确定结构简式.

| A. | 4种 | B. | 8种 | C. | 12种 | D. | 16种 |
| A. | CO2 | B. | PCl5 | C. | NF3 | D. | AlCl3 |
| A. | 乙醇、甲苯、硝基苯 | B. | 裂化汽油、甘油、四氯化碳 | ||
| C. | 苯、甲苯、环己烷 | D. | 乙醇、乙醛、乙酸 |
酸溶FeTiO3(S)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O(l)
水解TiOSO4(aq)+2H2O(l)$\frac{\underline{\;90℃\;}}{\;}$H2TiO3(S)+H2SO4(aq)
简要工艺流程如下:
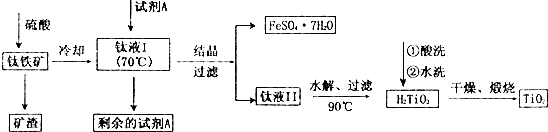
过量的试剂A除去的方法为( )
| A. | 过滤 | B. | 蒸发浓缩冷却结晶过滤 | ||
| C. | 水洗 | D. | 灼烧 |
| 加入物质 | 碳酸钠溶液 | 氢氧化钡溶液 | 氧化铜粉末 |
| 现象 | 产生无色气体 | 产生白色沉淀 | 固体溶解 |
| A. | HCl | B. | CaCl2 | C. | MgSO4 | D. | H2SO4 |
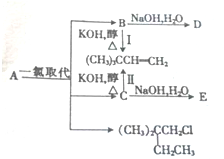 (1)A的分子式为C6H14,1molA完全燃烧消耗O29.5mol.
(1)A的分子式为C6H14,1molA完全燃烧消耗O29.5mol.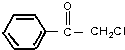
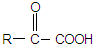
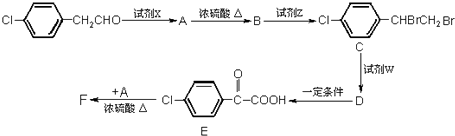
 .
.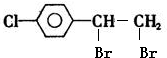 +2NaOH $→_{△}^{水}$
+2NaOH $→_{△}^{水}$ +2NaBr.
+2NaBr.