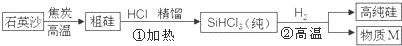
题目内容
7.下列各分子中所有原子都满足最外层为8电子结构的是( )| A. | CO2 | B. | PCl5 | C. | NF3 | D. | AlCl3 |
分析 根据原子最外层电子数和化合价判断,在化合物中,原子最外层电子数等于原子的价层电子数+|化合价|,以此解答该题.
解答 解:A.CO2中,C原子的最外层电子为:4+4=8,O原子的最外层电子为:6+|-2|=8,都满足8电子稳定结构,故A正确;
B.PCl5中,P原子的最外层电子为:5+5=10,Cl原子的最外层电子为:7+|-1|=8,不都满足8电子稳定结构,故B错误;
C.NF3中,N原子的最外层电子为:5+3=8,F原子的最外层电子为:7+|-1|=8,都满足8电子稳定结构,故C正确;
D.AlCl3中,Al原子的最外层电子为:3+3=6,Cl原子的最外层电子为:7+|-1|=8,不都满足8电子稳定结构,故D错误.
故选AC.
点评 本题考查原子的结构,本题中注意判断是否满足8电子结构的方法,注意利用化合价与最外层电子数来分析即可解答,明确所有原子都满足最外层8电子结构是解答的关键.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
17.图是元素X的原子结构示意图.下列说法正确的是( )
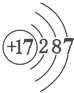

| A. | X属于金属元素 | B. | 该原子的核外电子数为7 | ||
| C. | X与Na形成的化合物为NaX | D. | 该原子最外电子层达到了稳定结构 |
18.下列对0.5mol N2叙述正确的是( )
| A. | 含0.5mol氮原子 | B. | 含1个氮分子 | ||
| C. | 其质量是14g | D. | 约含6.02×1023个氮分子 |
15.短周期元素甲,乙,丙,丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数和电子层数相等,则( )
| A. | 原子半径:丙<丁<乙 | |
| B. | 单质的还原性:丁>丙>甲 | |
| C. | 甲,乙,丙的氧化物均为共价化和物 | |
| D. | 乙,丙,丁的最高价氧化物对应的水化物能相互反应 |
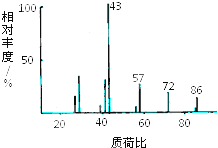 某有机物含有C、H、O三种元素,其质谱如图所示.将4.3g该有机物在O2中充分燃烧,使生成物依次通过足量浓硫酸和碱石灰,浓硫酸增重2.7g,碱石灰增重8.8g,则:
某有机物含有C、H、O三种元素,其质谱如图所示.将4.3g该有机物在O2中充分燃烧,使生成物依次通过足量浓硫酸和碱石灰,浓硫酸增重2.7g,碱石灰增重8.8g,则:
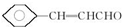 .
. ;
;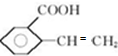 、
、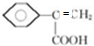 .
.