题目内容
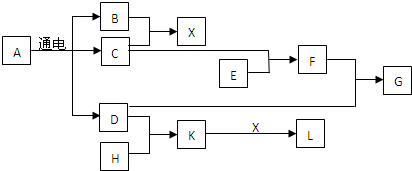
11.工业上由钛铁矿( FeTiO3)(含Fe2O3、SiO2 等杂质)制备TiO2的有关反应包括:酸溶FeTiO3(S)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O(l)
水解TiOSO4(aq)+2H2O(l)$\frac{\underline{\;90℃\;}}{\;}$H2TiO3(S)+H2SO4(aq)
简要工艺流程如下:
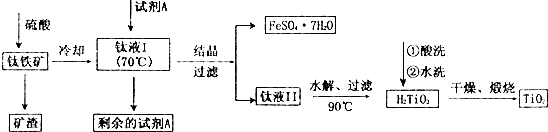
过量的试剂A除去的方法为( )
| A. | 过滤 | B. | 蒸发浓缩冷却结晶过滤 | ||
| C. | 水洗 | D. | 灼烧 |
分析 由制备流程可知,矿石经硫酸溶解后得到的Fe2(SO4)3,而结晶、过滤得到的是FeSO4•7H2O,所以试剂A是铁粉,把Fe3+还原为Fe2+,以此来解答.
解答 解:由制备流程可知,矿石经硫酸溶解后得到的Fe2(SO4)3,而结晶、过滤得到的是FeSO4•7H2O,所以试剂A是铁粉,铁粉不溶于水,则过滤可除去过量的A,
故选A.
点评 本题以物质制备流程考查混合物分离提纯,为高频考点,把握制备流程分析A为何种试剂为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
6.在密闭容器中进行X2(g)+4Y2(g)?2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别是0.1mol•L-1、0.4mol•L-1、0.4mol•L-1、0.3mol•L-1,当反应到某时刻时,各物质的浓度不可能是( )
| A. | c(X2)=0.15 mol•L-1 | B. | c(Y2)=0.7 mol•L-1 | ||
| C. | c(Y2)=0.3 mol•L-1 | D. | c(Q2)=0.6 mol•L-1 |
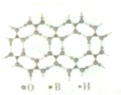 元素周期表可以指导我们寻找和合成成新的物质,如金属和非金属分界线附近的元素可用于制造半导体材料,是科学研究的热点
元素周期表可以指导我们寻找和合成成新的物质,如金属和非金属分界线附近的元素可用于制造半导体材料,是科学研究的热点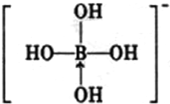 或
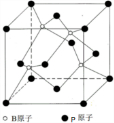
或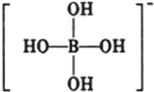 ,硼酸具有层状结构,每层结构如图所示,每摩尔晶体中所含氢键的数目为3NA(设NA为阿伏伽德罗常数的值)
,硼酸具有层状结构,每层结构如图所示,每摩尔晶体中所含氢键的数目为3NA(设NA为阿伏伽德罗常数的值)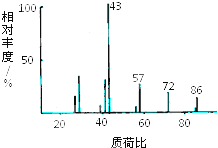 某有机物含有C、H、O三种元素,其质谱如图所示.将4.3g该有机物在O2中充分燃烧,使生成物依次通过足量浓硫酸和碱石灰,浓硫酸增重2.7g,碱石灰增重8.8g,则:
某有机物含有C、H、O三种元素,其质谱如图所示.将4.3g该有机物在O2中充分燃烧,使生成物依次通过足量浓硫酸和碱石灰,浓硫酸增重2.7g,碱石灰增重8.8g,则: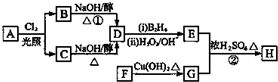
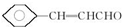 .
. ;
;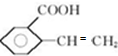 、
、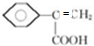 .
.
 ;HCl.
;HCl.