题目内容
运用反应原理研究氮、硫、氯、碘及其化合物的反应有重要意义。
(1)在反应:2SO2(g)+O2(g) 2SO3(g)的混合体系中,SO3的百分含量和温度的关系如下图(曲线上任何一点都表示平衡状态):
2SO3(g)的混合体系中,SO3的百分含量和温度的关系如下图(曲线上任何一点都表示平衡状态):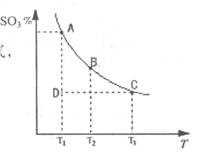
①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将 移动(填“向左”、“向右”或“不”);
2SO3(g)的△H 0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将 移动(填“向左”、“向右”或“不”);
②当温度为T1,反应进行到状态D时,V正 V逆(填“>”、“<”或“=”)。
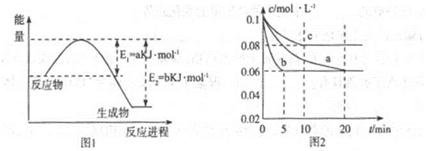
(2)①下图是一定条件下,N2和H2发生可逆反应生成1mol NH3的能量变化图,该反应的热化学反应方程式 。(△H用含Q1、Q2的代数式表示)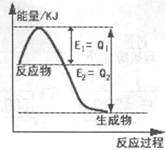
②25°C时,将a mol ? L―1的氨水与b mol ? L―1的盐酸等体积混合,所得溶液的pH=7,则c (NH4+) c(Cl―),a b(填“>”、“<”或“=”);
(3)海水中含有大量以化合态形式存在的氯、碘元素。已知:250C时,Ksp(AgCl)=1.6×10―10mol2?L―2、Ksp(AgI)=1.5×10―16mol2?L―2。
在 250C时,向 10mL0.002mol?L―1的 NaCl溶液中滴入 10mL0.002mol?L―1AgNO3溶液,有白色沉淀生成,向所得浊液中继续滴人0.1mol ?L―1的NaI溶液,白色沉淀逐渐转化为黄色沉淀,其原因是 ,该反应的离子方程式 。
(1)①< 向左 ②>
(2)①N2(g)+3H2(g)  2NH3(g) △H=-2(Q2-Q1)KJ·mol-1
2NH3(g) △H=-2(Q2-Q1)KJ·mol-1
(或1/2N2(g)+3/2H2(g)  NH3(g) △H=-(Q2-Q1)KJ·mol-1)
NH3(g) △H=-(Q2-Q1)KJ·mol-1)
②= >
(3)KSP(AgCl)>KSP(AgI) AgCl+I-=AgI+Cl-
解析试题分析:(1)①读图可知,随着温度升高,SO3的百分含量减小,前者使平衡向吸热方向移动,后者说明平衡向逆反应方向移动,因此逆反应是吸热反应,则正反应是△H<0的放热反应;恒温恒压时通入惰性气体,必须增大容器的体积、减小反应物和生成物的浓度,就是减小平衡体系的压强,由于正反应是气态物质体积减小的方向,减小压强使平衡向气态物质体积增大的方向移动,即平衡向左或逆反应方向移动;②SO3的百分含量:D<A,说明D为T1时的不平衡状态,反应应该向SO3的百分含量增大或正反应的方向进行,所以v正>v逆;(2)①读图可知,生成1molNH3(g)时放出的热量为(Q2—Q1)kJ,则1/2N2(g)+3/2H2(g) NH3(g) △H =—(Q2—Q1)kJ?mol―l,若系数加倍,则N2(g)+3H2(g)
NH3(g) △H =—(Q2—Q1)kJ?mol―l,若系数加倍,则N2(g)+3H2(g) 2NH3(g) △H =—2(Q2—Q1)kJ?mol―l;根据电解质溶液中电荷守恒可知,溶液中c(H+)+c(NH4+)=c(Cl―)+c(OH―),由于25℃时溶液的pH=7,则c(H+)= c(OH―),因此溶液中c(NH4+)=c(Cl―);由于NH3?H2O+HCl=NH4Cl+H2O,假设a=b,酸碱完全中和后得到的NH4Cl是强酸弱碱盐,所得溶液显弱酸性,pH<7,因此盐酸一定要不足,氨水一定要适当过量,所以a>b;(3)由于NaCl=Na++Cl―,则c(Cl―)=0.002mol?L―1,由于AgNO3=Ag++NO3―,则c(Ag+)=0.002mol?L―1;等体积混合后,c(Cl―)=0.001mol?L―1、c(Ag+)=0.001mol?L―1;由于AgCl(s)
2NH3(g) △H =—2(Q2—Q1)kJ?mol―l;根据电解质溶液中电荷守恒可知,溶液中c(H+)+c(NH4+)=c(Cl―)+c(OH―),由于25℃时溶液的pH=7,则c(H+)= c(OH―),因此溶液中c(NH4+)=c(Cl―);由于NH3?H2O+HCl=NH4Cl+H2O,假设a=b,酸碱完全中和后得到的NH4Cl是强酸弱碱盐,所得溶液显弱酸性,pH<7,因此盐酸一定要不足,氨水一定要适当过量,所以a>b;(3)由于NaCl=Na++Cl―,则c(Cl―)=0.002mol?L―1,由于AgNO3=Ag++NO3―,则c(Ag+)=0.002mol?L―1;等体积混合后,c(Cl―)=0.001mol?L―1、c(Ag+)=0.001mol?L―1;由于AgCl(s) Ag++Cl―,则Qc(AgCl)=10―3 mol?L―1×10―3 mol?L―1=10―6 mol2?L―2> Ksp(AgCl),故有白色沉淀生成;由于Ksp(AgCl)> Ksp(AgI),根据沉淀转化的规律可知,白色沉淀容易转化为黄色沉淀,即AgCl(s)+I―
Ag++Cl―,则Qc(AgCl)=10―3 mol?L―1×10―3 mol?L―1=10―6 mol2?L―2> Ksp(AgCl),故有白色沉淀生成;由于Ksp(AgCl)> Ksp(AgI),根据沉淀转化的规律可知,白色沉淀容易转化为黄色沉淀,即AgCl(s)+I― AgI(s)+Cl―,该反应的平衡常数K=c(Cl―)/c(I―)="[" c(Ag+)?c(Cl―)]/[ c(Ag+)?c(I―)]=Ksp(AgCl)/Ksp(AgI)= 1.6×10―10/1.5×10―16=1.07×106>105,因此正反应几乎进行到底,则该反应为AgCl(s)+I―=AgI(s)+Cl―。
AgI(s)+Cl―,该反应的平衡常数K=c(Cl―)/c(I―)="[" c(Ag+)?c(Cl―)]/[ c(Ag+)?c(I―)]=Ksp(AgCl)/Ksp(AgI)= 1.6×10―10/1.5×10―16=1.07×106>105,因此正反应几乎进行到底,则该反应为AgCl(s)+I―=AgI(s)+Cl―。
考点:以非金属及其化合物的重要性质为载体,考查化学平衡、反应热和热化学方程式、溶液中粒子浓度大小关系、溶度积的计算及沉淀的转化等考点。

 阅读快车系列答案
阅读快车系列答案研究硫及其化合物的性质有重要意义。
(1)Cu2S在高温条件下发生如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ⊿H=-773kJ/mol
当该反应有1.2mol电子转移时,反应释放出的热量为 kJ。
(2)硫酸工业生产中涉及反应:2SO2(g)+O2(g) 2SO3(g),SO2的平衡转化率与温度、压强的关系如右图所示。
2SO3(g),SO2的平衡转化率与温度、压强的关系如右图所示。
①压强:P1 P2(填“>”、“=”或“<”)。
②平衡常数:A点 B点(填“>”、“=”或“<”)。
③200℃下,将一定量的SO2和O2充入体积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
| 气体 | SO2 | O2 | SO3 |
| 浓度(mol/L) | 0.4 | 1.2 | 1.6 |
能说明该反应达到化学平衡状态的是 。
a.SO2和O2的体积比保持不变
b.体系的压强保持不变
c.混合气体的密度保持不变
d.SO2和SO3物质的量之和保持不变
计算上述反应在0~10min内,υ(O2)= 。
(3)一定温度下,用水吸收SO2气体时,溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若得到pH=3的H2SO3溶液,试计算溶液中
 。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2 mol/L,Ka2=6.0×10-3 mol/L)
。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2 mol/L,Ka2=6.0×10-3 mol/L) 目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g) △H=-93.0kJ /mol;另据报道,一定条件下:2N2(g)+6H2O(l)
2NH3(g) △H=-93.0kJ /mol;另据报道,一定条件下:2N2(g)+6H2O(l) 4NH3(g)+3O2(g) △H=" +1530.0kJ" /mol。
4NH3(g)+3O2(g) △H=" +1530.0kJ" /mol。
(1)氢气的燃烧热△H=_______________kJ/mol。
(2)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是 。
| A.气体体积不再变化,则已平衡 |
| B.气体密度不再变化,尚未平衡 |
| C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动 |
| D.平衡后,压缩装置,生成更多NH3 |
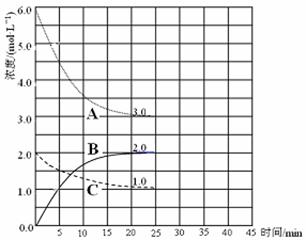
① 表示N2浓度变化的曲线是 。
② 前25 min 内,用H2浓度变化表示的化学反应速率是 。
③ 在25 min末刚好平衡,则平衡常数K = 。
(4)在第25 min 末,保持其它条件不变,升高温度,在第35 min末再次平衡。平衡移动过程中H2浓度变化了1.5 mol·L-1,在图中画出第25 min ~ 40 min NH3浓度变化曲线。
(5)已知常温下,NH4+ 的水解常数为1.0×10-9,则0.1mol/L NH4Cl溶液pH= 。(忽略NH4+水解对NH4+浓度的影响)
 SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
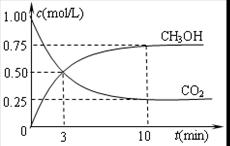
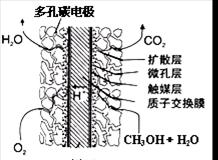
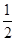 O2(g)═CO2(g) △H=-283.0kJ/mol
O2(g)═CO2(g) △H=-283.0kJ/mol CO2(g)+H2(g) △H<0在恒容密闭容器中,起始时n(H2O)=0.20mol,n(CO)=0.10 mol,在8000C时达到平衡状态,K=1.0,则平衡时,容器中CO的转化率是_____________(计算结果保留一位小数)。
CO2(g)+H2(g) △H<0在恒容密闭容器中,起始时n(H2O)=0.20mol,n(CO)=0.10 mol,在8000C时达到平衡状态,K=1.0,则平衡时,容器中CO的转化率是_____________(计算结果保留一位小数)。 2NH3(g)(△H<0)在等容条件下进行,改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
2NH3(g)(△H<0)在等容条件下进行,改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
 2NH3(g)△H<0
2NH3(g)△H<0
 CO(g) + 3H2(g) ΔH>0
CO(g) + 3H2(g) ΔH>0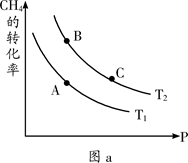
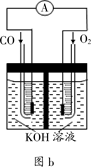

 2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
