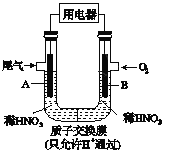
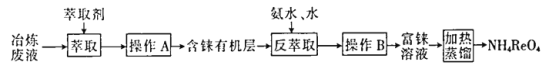
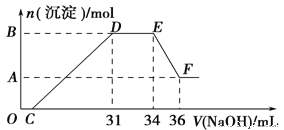
题目内容
【题目】已知 A、B、C、D、E、F 是六种短周期主族元素,原子序数依次增大。A、C、F 的单质在常温下呈气态,B 的原子最外层电子数是其电子层数的 2 倍,A 与 D 同主族,C 的气态氢化物能与其最高价氧化物的水化物反应,E 是地壳中含量最高的金属元素。清回答下列问题:
(1)F 的元素符号为______,B、C、D、E 四种元素原子半径由大到小的顺序是(写元素符号)_____。
(2)B 在元素周期表中的位置为_____,B 与硫元素形成的二元化合物的电子式为_____。
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式)_____。
(4)由 A,C,F 组成的一种常见的盐中结构中包含_____(选填“离子键”“极性键”和“非极性键”)
(5)单质 B 和元素 C 的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为______。
【答案】Cl Na>Al>C>N 第二周期第ⅣA族 ![]() HClO4 离子键 极性键 C+4HNO3(浓)
HClO4 离子键 极性键 C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
【解析】
C 的气态氢化物能与其最高价氧化物的水化物反应,则C为N元素;E 是地壳中含量最高的金属元素,则E是是Al元素;A、B、C、D、E、F六种短周期主族元素原子序数依次增大,B 的原子最外层电子数是其电子层数的 2 倍,则B是C元素;A、C、F 的单质在常温下呈气态,则A为H元素、F为Cl元素;A 与 D 同主族,则D为Na元素。
(1)F为Cl元素;同周期元素从左到右,原子半径依次减小,同主族元素,从上到下原子半径依次增大,则C、N、Na、Al四种元素原子半径由大到小的顺序是Na>Al>C>N,故答案为:Cl;Na>Al>C>N;
(2)B是C元素,位于周期表第二周期ⅣA族;碳元素与硫元素形成的二元化合物的化学式为CS2,都是为![]() ,故答案为:第二周期ⅣA族;
,故答案为:第二周期ⅣA族;![]() ;
;
(3)元素非金属性越强,最高价氧化物对应的水化物酸性越强,A、B、C、D、E、F六种短周期主族元素中Cl元素非金属性最强,则Cl元素的最高价氧化物对应的水化物HClO4的酸性最强,故答案为:HClO4;
(4)A为H元素、C为N元素、F为Cl元素,三者组成的铵盐为氯化铵,氯化铵中铵根离子和氯离子形成离子键,铵根离子中N原子和氢原子形成极性共价键,故答案为:离子键和极性键;
(5)单质 B为碳,C 的最高价氧化物对应水化物为硝酸,碳单质和浓硝酸共热反应生成二氧化碳、二氧化氮和水,反应的化学方程式为C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O,故答案为:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O,故答案为:C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O。
CO2↑+4NO2↑+2H2O。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案【题目】分类是学习化学的一种重要思想,下列关于物质的分类组合正确的是( )
分类组合 | 酸 | 碱 | 盐 | 酸性氧化物 | 碱性氧化物 |
A | 盐酸 | Na2CO3 | K2CO3 | CO2 | CaO |
B | 硝酸 | Ca(OH)2 | NaHSO4 | MgO | CO |
C | 硫酸 | 烧碱 | NaHCO3 | P2O5 | Na2O |
D | H2CO3 | Na2CO3 | CaCO3 | SO2 | CuO |
A. A B. B C. C D. D