��Ŀ����
����Ŀ����ͼ��ʾ��B�� D����ѧ��ѧ����������D��������Ӧ����㷺��

(1)д������A�����ᷴӦ�����ӷ���ʽ_____��
(2)̽��A��B��Ӧ���������ʣ�����Ӧ�������еIJ�����������ձ��У�����100mLϡ���ᣬ������ȫ�ܽ⣬ (�������ȫ���ܽ����Һ�������)����Ӧ������������ų� (���ý����ɰ�ϡHNO3��ԭΪNH4NO3)����Ӧ�����Һ�л����μ�4mol��L��1��NaOH��Һ���������������ʵ��������NaOH��Һ������Ĺ�ϵ��ͼ��ʾ��
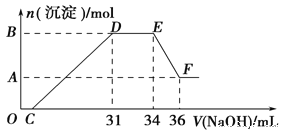
��д��DE�η�����Ӧ�����ӷ���ʽ��_____��
��B��A�IJ�ֵΪ_____mol��
����c(HNO3)=_____��
���𰸡�Fe3O4 +8H+=2Fe3+ +Fe2++4H2O NH4++OH���TNH3H2O 0.008 1.48mol/L
��������
��1��B��D����ѧ��ѧ����������D��������Ӧ����㷺����DΪFe���������е�ȼ����A����AΪFe3O4��B��Fe3O4���������û��������ʣ���BΪAl�����߷������ȷ�Ӧ���ɴ��Ƴ�CΪAl2O3���ݴ˷�������
��2��O��C ֮��û�г������ɣ�˵�����������O��C֮�䷢���ķ�Ӧ����кͷ�Ӧ�����ӷ���ʽΪH++OH-�TH2O��
D��Eһ�γ���������û�з����仯��ΪNH4NO3��NaOH��Ӧ����Ӧ�����ӷ���ʽΪ��NH4++OH-�TNH3H2O��
E��F֮������������٣��϶�����ΪAl(OH)3�ܽ�������������Һ�У���Ӧ�����ӷ���ʽΪAl(OH)3+OH-=AlO2-+2H2O���Դ˽��н��
��1����������������֪��AΪFe3O4����Fe3O4��ϡ���ᷴӦ�����ӷ���ʽΪ��Fe3O4 +8H+=2Fe3+ +Fe2++4H2O��
�ʴ�Ϊ��Fe3O4 +8H+=2Fe3+ +Fe2++4H2O��
��2����OC����H++OH-�TH2O��CD��Ӧ����������������������������D��Eһ�γ���������û�з����仯��ΪNH4NO3��NaOH��Ӧ�����ӷ���ʽΪ��NH4++OH-�TNH3H2O��
�ʴ�Ϊ��NH4++OH-�TNH3H2O��
��E��F֮������������٣�ΪAl(OH)3�ܽ�������������Һ�У�
�䷴Ӧ����ʽΪAl(OH)3+NaOH=NaAlO2+2H2O��
EF�ε�n��NaOH��=4mol/L��2��10-3L=0.008mol��
Al(OH)3+NaOH=NaAlO2+2H2O
1 mol 1mol
0.008 mol 0.008mol
Al(OH)3������0.008mol������Al3+Ҳ��0.008mol��
����B��A��ֵΪ0.008 mol��
�ʴ�Ϊ��0.008��
�ۼ���34 mLNaoH��Һʱ������Ϊ�����ƣ�ԭ��Һ������ת��ΪΪ�����ƺ�һˮ�ϰ������֣����������������ĵ�����Ϊ��4 mol/L��34��10-3L=0.136mol��һˮ�ϰ������ʵ���Ϊ��4mol/L����34-31����10-3 L=0.012 mol��
������������ʵ���Ϊ��0.136mol+0.012mol=0.148mol��������ҺŨ��Ϊ��![]() =1.48mol/L��
=1.48mol/L��
�ʴ�Ϊ��1.48mol/L��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ������ʵ��װ�ã�����װ������ȥ��������������ǣ� ��
|
|
|
|
A�����հ����������� | B����SO2��Ba(NO3)2��Ӧ���BaSO3���� | C�������屽�ͱ��Ļ���� | D. ��֤HCl���ܽ��� |
A. A B. B C. C D. D