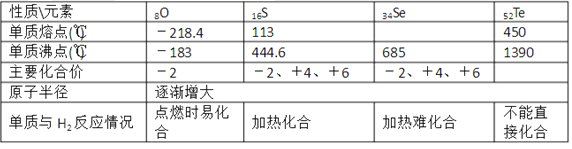
题目内容
【题目】将Mg、Al、Zn组成的混合物与足量的盐酸作用,放出H2的体积为2.8L(标准状况下),则这三种金属的物质的量之和可能为
A. 0.250mol B. 0.100mol C. 0.125mol D. 0.080mol
【答案】B
【解析】
Mg、Zn与盐酸反应都生成+2价的氯化物和H2,Al与HCl反应生成AlCl3和H2,用极限法求出生成+2价金属氯化物和+3价金属氯化物时金属物质的量,根据混合物的特点判断。
n(H2)=![]() =0.125mol;Mg、Zn与盐酸反应都生成+2价的氯化物和H2,假设混合物中只有Mg、Zn,反应的通式为M+2HCl=MCl2+H2↑(M代表Mg或Zn),则金属物质的量等于n(H2)=0.125mol;假设混合物中只有Al,反应的化学方程式为2Al+6HCl=2AlCl3+3H2↑,则n(Al)=
=0.125mol;Mg、Zn与盐酸反应都生成+2价的氯化物和H2,假设混合物中只有Mg、Zn,反应的通式为M+2HCl=MCl2+H2↑(M代表Mg或Zn),则金属物质的量等于n(H2)=0.125mol;假设混合物中只有Al,反应的化学方程式为2Al+6HCl=2AlCl3+3H2↑,则n(Al)=![]() n(H2)=
n(H2)=![]() ×0.125mol=0.083mol;由于混合物由Mg、Al、Zn混合而成,三种金属物质的量之和应大于0.083mol小于0.125mol,对照各选项,答案选B。
×0.125mol=0.083mol;由于混合物由Mg、Al、Zn混合而成,三种金属物质的量之和应大于0.083mol小于0.125mol,对照各选项,答案选B。

练习册系列答案
相关题目
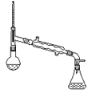
【题目】下列实验装置(加热装置已略去)或操作合理的是( )
|
|
|
|
A.吸收氨气并防倒吸 | B.用SO2与Ba(NO3)2反应获得BaSO3沉淀 | C.分离溴苯和苯的混合物 | D. 验证HCl的溶解性 |
A. A B. B C. C D. D