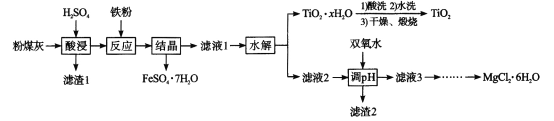
题目内容
【题目】一种固定CO2的电化学装置如图,该电化学装置放电时可将CO2转化为Li2CO3和C,充电时选用合适催化剂,只有Li2CO3发生氧化反应,释放出CO2和O2。下列说法正确的是

A.放电时,Li+向电极X方向移动
B.充电时,电极Y应与外接直流电源的负极相连
C.充电时,阳极的电极反应式为C +2Li2CO3-4e- =3CO2 ↑+4Li +
D.充电时,每转移0.4mol电子,理论上阳极生成标准状况下4.48LCO2
【答案】D
【解析】
根据题干分析可知,放电时,X极上Li失电子,则X为负极,Y为正极,正极上CO2得电子生成C和Li2CO3;充电时,阴极上Li+得电子生成Li,阳极上Li2CO3发生氧化反应,释放出CO2和O2,电极反应式为2Li2CO3-4e-==2CO2↑+4Li++O2↑,据此分析解答。
A.放电时,X极上Li失电子,则X为负极,Y为正极,阳离子向正极移动,即Li+向电极Y方向移动,A选项错误;
B.该电池充电时,电源的负极与外加电源的负极相连,即电极X与外接直流电源的负极相连,B选项错误;
C.阳极上Li2CO3发生氧化反应,释放出CO2和O2,电极反应式为2Li2CO3-4e-==2CO2↑+4Li++ O2↑,C选项错误;
D.电池充电时,只有Li2CO3发生氧化反应,所以反应式为2Li2CO3-4e-==2CO2↑+4Li++O2↑每转移0.4mol电子,理论上阳极产生0.2molCO2,标准状况下的体积为4.48L,D选项正确;
答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】高炉炼铁过程中发生反应: ![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g),该反应在不同温度下的平衡常数见右表。下列说法正确的是( )
Fe(s)+CO2(g),该反应在不同温度下的平衡常数见右表。下列说法正确的是( )
温度T/℃ | 1000 | 1150 | 1300 |
平衡常数K | 4.0 | 3.7 | 3.5 |
A. 由表中数据可判断该反应:反应物的总能量<生成物的总能量
B. 1000℃下Fe2O3与CO反应,t min达到平衡时c(CO) =2×10-3 mol/L,则用CO2表示该反应的平均速率为2×10-3/t mol·L-1·min-1
C. 为了使该反应的K增大,可以在其他条件不变时,增大c(CO)
D. 其他条件不变时,增加Fe2O3的用量,不能有效降低炼铁尾气中CO的含量