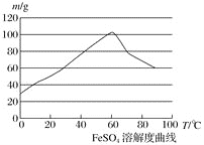
题目内容
【题目】“绿水青山就是金山银山”,运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对工业生产、缓解环境污染、解决能源危机等具有重要意义。
(1)已知:①C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol
②C(s)+CO2(g)=2CO(g) △H2=+172.5kJ/mol
③4Fe(s)+3O2(g)=2Fe2O3(s) △H3=-1651.0kJ/mol
CO还原氧化铁的热化学方程式为_____________。
(2)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
H2CO3 | H2S | |
Ka1 | 4.410-7 | 1.310-7 |
Ka2 | 4.710-11 | 7.110-15 |
①煤的气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为_______;
②常温下,0.1mol·L-1 NaHCO3溶液和0.1mol·L-1 NaHS溶液的pH相比,pH较小的为________ 溶液(填化学式)。
(3)一定条件下,向某恒容密闭容器中充入x mol CO2和y mol H2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH (此反应在低温时为自发反应)。
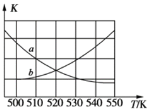
①下图能表示该反应的平衡常数K与温度T之间的变化关系曲线为_____(填“a”或“b”),其判断依据是__________。
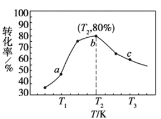
②若x=2、y=3,测得在相同时间内不同温度下H2的转化率如下图所示,则在该时间段内,恰好达到化学平衡时,此时容器内的压强与反应开始时的压强之比为_____________。
(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成28g N2时,转移的电子数为____mol(结果保留三位有效数字)。
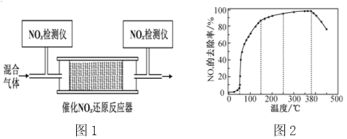
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置如图1)。反应相同时间NOx的去除率随反应温度的变化曲线如图2所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是______;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是____。
【答案】Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-23.5 kJ![]() mol-1
mol-1 ![]() +H2S=
+H2S=![]() +HS- NaHCO3 a 该反应是放热反应,升高温度反应逆向进行,会使平衡常数减小 17︰25 3.43 迅速上升段是催化剂活性随温度升高而增大,与温度升高共同使NOx去除反应速率迅速增大;上升缓慢段主要是温度升高引起的NOx去除反应速率增大,催化剂活性下降 NH3与O2反应生成了NO或氨气和氧气发生副反应
+HS- NaHCO3 a 该反应是放热反应,升高温度反应逆向进行,会使平衡常数减小 17︰25 3.43 迅速上升段是催化剂活性随温度升高而增大,与温度升高共同使NOx去除反应速率迅速增大;上升缓慢段主要是温度升高引起的NOx去除反应速率增大,催化剂活性下降 NH3与O2反应生成了NO或氨气和氧气发生副反应
【解析】
(1)根据盖斯定律进行计算;
(2) 根据强酸制弱酸原理,电离常数大的制备电离常数小的;根据水解常数Kb=![]() 计算同浓度时盐的pH值;
计算同浓度时盐的pH值;
(3)根据勒夏特列原理判断,利用三段式计算;
(4)根据氧化还原反应计算。
(1)根据盖斯定律,CO还原氧化铁的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=1.5 △H1-1.5△H2-0.5△H3=-23.5 kJ![]() mol-1。
mol-1。
(2)氢硫酸、碳酸均为二元弱酸,根据表格可知,硫化氢的第二步电离常数小于碳酸的第一步电离常数,根据强酸制弱酸的原理, ①煤的气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为![]() +H2S=
+H2S=![]() +HS-;
+HS-;
②根据水解常数Kb=![]() 可知,碳酸的第一步电离常数大于硫化氢的第一步电离常数,故碳酸氢根的水解常数小于硫氢根水解常数,两者水解产生氢氧根离子,故常温下,0.1mol·L-1 NaHCO3溶液和0.1mol·L-1 NaHS溶液的pH相比,pH较小的为NaHCO3溶液。
可知,碳酸的第一步电离常数大于硫化氢的第一步电离常数,故碳酸氢根的水解常数小于硫氢根水解常数,两者水解产生氢氧根离子,故常温下,0.1mol·L-1 NaHCO3溶液和0.1mol·L-1 NaHS溶液的pH相比,pH较小的为NaHCO3溶液。
(3) ①该反应是放热反应,升高温度不利于反应向右进行,会使平衡常数减小,曲线a符合此特点;
②由图可知,当温度在T2时,H2的转化率最高。温度越高反应速率越大,在相同时间内达到平衡状态前,H2的转化率最高,但达到平衡状态后继续升温,反应会向逆反应方向移动,导致H2的转化率降低,由图知b点为平衡状态:
![]()
反应前 2 3 0
反应 0.8 3×80% 0.8
同温同体积时,压强比等于物质的量比,故b点时对应的压强与反应开始时的压强比为34:50=17:25;
(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①①NH3与NO2生成N2的反应方程式为8NH3+6NO2=7N2+12H2O,该反应中生成7mol N2时,转移的电子的物质的量为24mol,因此生成1mol N2时转移电子的物质的量为![]() mol=3.43mol;
mol=3.43mol;
②在一定温度范围内催化剂活性较大,超过温度范围,催化剂活性降低,由图可知迅速上升段是催化剂活性随温度升高而增大,与温度升高共同使NOx的去除反应速率增大;上升阶段缓慢主要是温度上高引起的NOx的去除反应速率增大但催化剂活性降低;在一定温度和催化剂存在的条件下,氨气能催化氧化生成NO,当温度高于380℃时,NOx的去除反应速率下降的原因可能是氨气在该反应条件下与氧气反应生成NO或氨气和氧气发生副反应。