题目内容
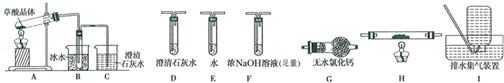
3.Ⅰ、实验室里用图1所示的装置制无水CuCl2,根据图示回答下列问题: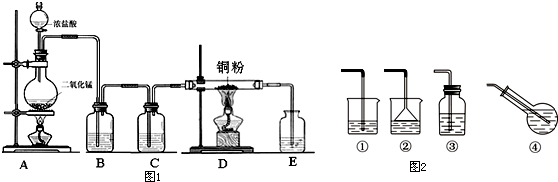
(1)写出烧瓶中发生反应的化学方程式,并标出电子转移情况:
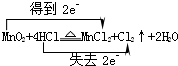 .
.(2)B瓶盛放的试剂是饱和食盐水(填名称),其作用是除去HCl;C瓶盛放的试剂是浓硫酸(填名称),其作用是干燥Cl2;
(3)实验开始时,应首先检验装置的气密性;实验结束应先熄灭D处的酒精灯;
(4)写出D处管内反应的化学方程式:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2;
Ⅱ、(1)若制备饱和氯水,图2吸收装置中最佳的选择是④;
(2)用滴管将新制氯水慢慢滴入含酚酞的NaOH溶液中,当滴到最后一滴时,红色褪去.产生上述现象的可能原因有两种:①氯水显酸性,NaOH溶液被中和而褪色;②氯水中的HClO将酚酞氧化而褪色.请你帮他设计实验证明红色褪去的原因是①还是②.
| 实验操作 | 实验现象 | 结 论 |
| 向已褪色的溶液中加入适量NaOH溶液 | 溶液变红 | 假设①成立 |
| 溶液不变红 | 假设②成立 |
分析 Ⅰ、(1)A为制备氯气装置,装置A中反应为二氧化锰与盐酸反应生成氯化锰、氯气、水,根据化合价变化标出电子转移的方向和数目;
(2)制纯净干燥的氯气,要除去混在氯气中的氯化氢和水蒸气,除去氯化氢气体用饱和食盐水,除去水用浓硫酸;
(3)该实验是有气体参与的反应,所以首先应检验装置的气密性,实验结束时为防止水蒸气进入装置,还要继续通一会儿氯气;
(4)D处管内反应为铜与氯气生成氯化铜;
Ⅱ、(1)氯气的溶解度不大,不需要防倒吸,氯气易挥发据此分析;
(2)利用继续滴加碱的方法来设计实验,若红色恢复说明酸碱中和使碱减少,若红色不恢复,则说明是次氯酸的作用.
解答 解:(1)A为制备氯气装置,装置A中反应为二氧化锰与盐酸反应生成氯化锰、氯气、水,反应方程式为 ,
,
故答案为: ;
;
(2)浓盐酸具有挥发性,所以制备的氯气中含有氯化氢,氯化氢极易溶于水,氯气的溶解度较小,所以可用饱和食盐水(或水)除去氯气气体中的氯化氢,所以B瓶中的试剂是饱和食盐水,作用是除去HCl,制备的氯气中含有水蒸气,可以用浓硫酸除去,所以C瓶盛放的试剂是浓硫酸,作用是干燥Cl2,
故答案为:饱和食盐水;除去HCl;浓硫酸;干燥Cl2;
(3)该实验是有气体参与的反应,所以首先应检验装置的气密性,实验结束时为防止水蒸气进入装置,还要继续通一会儿氯气,所以实验结束应先熄灭D处的酒精灯
故答案为:气密性;D;
(4)D处管内反应为铜与氯气生成氯化铜,反应方程式为Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2,
故答案为:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2;
Ⅱ、(1)①氯气溶解度不大,易挥发,故①不选;
②氯气的溶解度不大,不需要防倒吸,所以不用B装置,故②不选;
③装置密封,气体难以通入,故③不选;
④氯气易挥发,④装置能加大氯气与水的接触面积,有利于氯气的吸收,故④选;
故答案为:④;
(2)因次氯酸漂白后的溶液再加NaOH溶液不会恢复颜色,则继续向溶液中滴加NaOH溶液,若红色恢复说明酸碱中和使碱减少,若红色不恢复,则说明是次氯酸的作用,设计的实验为
| 实验操作 | 实验现象 | 结论 |
| 向已褪色的溶液中加入适量NaOH溶液 | 溶液变红 | ①成立 |
| 溶液不变红 | ②成立 |
故答案为:向已褪色的溶液中加入适量NaOH溶液;溶液变红;溶液不变红.
点评 本题考查学生对实验原理、实验装置的理解、物质的制备与性质,难度中等,实验室制取氯气的注意事项:1、必须用浓盐酸,稀盐酸不反应.2、为了减少制得的氯气中氯化氢的含量,所以加热温度不宜过高,浓盐酸具有挥发性.3、实验结束后,先使反应停止并排出残留的氯气,再拆卸装置,避免污染空气.4、尾气吸收时,不能用澄清石灰水吸收氯气,因为溶液中含有氢氧化钙的量少,吸收不完全.

 通城学典默写能手系列答案
通城学典默写能手系列答案| A. | 2H2(g)+O2(g)═2H2O(g),△H1; 2H2(g)+O2(g)═2H2O(l),△H2 | |
| B. | S(s)+O2(g)═SO2(g),△H1; S(g)+O2(g)═SO2(g),△H2 | |
| C. | C(s)+$\frac{1}{2}$ O2(g)═CO(g),△H1; C(s)+O2(g)═CO2(g),△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g),△H1; $\frac{1}{2}$H2(g)+$\frac{1}{2}$ Cl2(g)═HCl(g),△H2 |
| A. | 氢气在氯气中燃烧,发出苍白色火焰,瓶口上方有白色烟雾 | |
| B. | 铜在氯气中燃烧,产生棕黄色烟,产物溶于水,溶液呈蓝绿色 | |
| C. | 铁丝在氯气中燃烧,产生红色的浓烟,产物溶于水,溶液呈浅绿色 | |
| D. | 钠在空气中燃烧,发出黄色的火焰,生成白色固体 |
| A. | 氢氧化铝可作胃酸过多的中和剂 | |
| B. | 为了防止中秋月饼等富脂食品氧化变质,延长食品保质期,在包装袋中常放入生石灰 | |
| C. | “加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是对应的单质分子,而钙、铁则指的是对应的钙离子和铁离子 | |
| D. | PM2.5是指大气中直径接近2.5微米的颗粒物,入肺影响健康,这种颗粒物分散空气中形成胶体,它具有丁达尔现象 |
Ⅰ.分别向盛有0.5g Na2CO3固体、0.5gNaHCO3固体的烧杯中加入10mL水(20℃),搅拌,测量温度 为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10mL 密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度T3.
得到下表的数据:
| 温度 试剂 | T1/℃ | T2/℃ | T2/℃ |
| Ha2CO2 | 23.3 | 20.0 | 23.7 |
| HaCO2 | 18.5 | 20.0 | 20.8 |
(1)NaHCO3溶于水显碱性,其原因是HCO3-+H2O?H2CO3+OH-(用离子方程式表示).
(2)根据试题后的附表判断:步骤Ⅰ中Na2CO3、NaHCO3固体能否全部溶解是(填“是”或“否”).
(3)分析表1的数据得出:Na2CO3固体溶于水放热,NaHCO3固体溶于水吸热(填“放热”或“吸热”).
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应.乙同学认为应该增加一个实验,并补做如下实验:向 盛 有10mL水(20℃)的烧杯中加入10mL密度约为1.1g/mL20%的盐酸(20℃),搅拌,测量温度为22.2℃.
(5)结合上述探究,下列说法正确的是AC.
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,设计了如下实验方案,其中不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是C
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体.
若按A方案进行实验,则原混合物中NaHCO3的质量分数为$\frac{84b}{31a}$×100%(用含a、b的代数式表示)
附表:溶解度表
| 温度 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Ha2CO2 | 12.5g | 21.5g | 39.7g | 40.g |
| HaHCO2 | 8.1g | 9.6g | 11.1g | 12.7 |
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 |  |  |  |  |  |  |
(1)如果所制得气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号)
③接⑤接④接②接①接⑥;其中,②与④装置相连时,玻璃管接口(用装置中字母表示)应是接C.
(2)装置⑥中发生反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
(3)实验开始时,应首先检验装置的气密性;实验结束时,应先熄灭①处的酒精灯.
(4)在装置⑤的烧瓶中,发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2+2H2O
(5)待充分反应后,装置①的玻璃管中呈棕黄色.冷却后,将制得的产物配成溶液,溶液呈绿(或蓝绿)色.
(6)若反应中有71gCl2生成,则被氧化的HCl的物质的量为2mol,转移电子数为2NA.

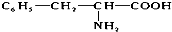 )相同,且同时符合下列两个条件:①苯环上带有两个取代基,②有一个硝基直接连在苯环上,则符合此条件的同分异构体数目是( )
)相同,且同时符合下列两个条件:①苯环上带有两个取代基,②有一个硝基直接连在苯环上,则符合此条件的同分异构体数目是( )