题目内容
【题目】一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸(H3BO3)及轻质氧化镁的工艺流程如下:
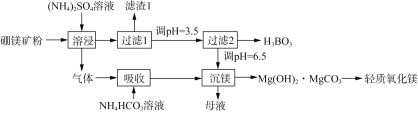
回答下列问题:
(1)“溶浸”硼镁矿粉过程中,提高B、Mg元素的浸出率可以采用什么措施________(填写两点)。
(2)“溶浸”后产生的气体是__________(填化学式)。
(3)为检验“过滤1”后的滤液中是否含有Fe3+,可选用的化学试剂是______________溶液(填化学式)。
(4)根据H3BO3的解离反应:H3BO3+H2O![]() H++B(OH)4,Ka=5.81×10-10,写出H3BO3与NaOH反应的离子方程式________________________________________。
H++B(OH)4,Ka=5.81×10-10,写出H3BO3与NaOH反应的离子方程式________________________________________。
(5)写出“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式以及将碱式碳酸镁高温灼烧制备轻质氧化镁的化学方程式________________、____________。
【答案】适当提高溶浸温度、适当提高溶浸液(NH4)2SO4溶液浓度、适当延长溶浸时间、搅拌等 NH3 KSCN溶液 H3BO3+OH-=B(OH)4- 2Mg2++3CO32-+2H2O=Mg(OH)2·MgCO3↓+2HCO3- (或2Mg2++H2O+2CO32-=Mg(OH)2·MgCO3↓+CO2↑) Mg(OH)2·MgCO3![]() 2MgO+CO2↑+H2O
2MgO+CO2↑+H2O
【解析】
硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)加入硫酸铵溶液,得到气体,根据硼镁矿和硫酸铵化学式知,得到的气体为NH3,用NH4HCO3吸收NH3,发生反应NH3+NH4HCO3=(NH4)2CO3,根据过滤2及沉镁成分知,过滤1中得到的滤渣为难溶性的SiO2、Fe2O3、Al2O3,调节溶液pH=3.5时得到H3BO3,滤液中含有MgSO4,沉镁过程发生的反应为2Mg2++3CO32-+2H2O=Mg(OH)2MgCO3↓+2HCO3-,加热分解可以得到轻质MgO;母液中含有(NH4)2SO4,以此解答该题。
(1)“溶浸”硼镁矿粉过程中,为提高B、Mg元素的浸出率可以采用的措施有适当提高溶浸温度、适当提高溶浸液(NH4)2SO4溶液浓度、适当延长溶浸时间、搅拌等;
(2)根据硼镁矿及(NH4)2SO4化学式可知:“溶浸”后产生的气体是NH3;
(3)取该滤液少许,向其中滴加KSCN溶液,若溶液会变为血红色,就证明该滤液中含有Fe3+,否则不含有Fe3+;
(4)根据H3BO3的解离反应:H3BO3+H2O![]() H++B(OH)4,Ka=5.81×10-10,说明H3BO3是一元弱酸,因此H3BO3与NaOH反应的离子方程式为:H3BO3+OH-=B(OH)4-;
H++B(OH)4,Ka=5.81×10-10,说明H3BO3是一元弱酸,因此H3BO3与NaOH反应的离子方程式为:H3BO3+OH-=B(OH)4-;
(5)在“沉镁”中Mg2+和CO32-离子发生水解和复分解反应生成Mg(OH)2·MgCO3↓沉淀,同时还生成HCO3,离子方程式为:2Mg2++3CO32-+2H2O=Mg(OH)2·MgCO3↓+2HCO3- (或2Mg2++H2O+2CO32-=Mg(OH)2·MgCO3↓+CO2↑) 。将Mg(OH)2·MgCO3沉淀经洗涤后加热,发生分解反应:Mg(OH)2·MgCO3![]() 2MgO+CO2↑+H2O,就制取得到轻质氧化镁。
2MgO+CO2↑+H2O,就制取得到轻质氧化镁。

【题目】有关元素X、Y、D、E的信息如下:
元素 | 有关信息 |
X | 地壳中含量最高的元素 |
Y | 第三周期中原子半径最小的元素 |
D | 最高价氧化物既能溶于强酸又能溶于强碱 |
E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
用化学用语回答下列问题:
(1)D在元素周期表中的位置为____。
(2)X、Y、D形成的简单离子的半径由大到小为_____。
(3)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为_________,D的单质溶于强碱的离子方程式为________。
(4)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是(填序号)_____。
①保存EY2溶液时,需向溶液加入少量E单质
②EY2、EY3均能通过化合反应生成
③向煮沸的NaOH溶液中滴加几滴饱和EY3溶液,可以制得胶体