题目内容
【题目】碳酸盐燃料电池,以一定比例的Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为3:1)直接作燃料,其工作原理如图所示,并以此电源用于工业生产。
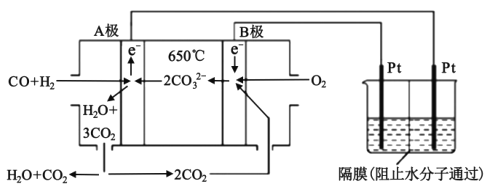
(1)H2(g)、CO(g)的燃烧热△H分别为-285.8kJmol-1、-283.0kJmol-1,18g液态水变为水蒸气时吸热44.0kJ,则电池总反应3CO(g)+H2(g)+2O2(g)=3CO2(g)+H2O(g)的△H=___kJmol-1,B电极上发生反应的电极反应式为___。
(2)若以此电源生产新型硝化剂N2O5,装置如图所示。已知两室加入的试剂分别是a.硝酸溶液;b.N2O4+无水硝酸,则左室加入的试剂应为___(填“a”或“b”),其电极反应式为___。
(3)若以此电源用惰性电极电解足量的硝酸银溶液,阴极产物的质量为5.4g,则阳极产生的气体在标准状况下的体积为___L。电解后溶液体积为500mL,溶液的pH约为___。
【答案】-1090.8 2CO2+O2+4e-=2CO32- b N2O4+2HNO3-2e-=2N2O5+2H+ 0.28 1
【解析】
(1)结合已知条件书写热化学方程式,根据盖斯定律计算;该装置为燃料电池,通入燃料的一极为负极,通入氧气的一极为正极,则A为负极,B为正极,B电极上氧气和二氧化碳得电子,发生还原反应;
(2)先根据化合价判断生成N2O5的电极,再根据离子的放电顺序写出电极反应式;
(3)依据消耗的氧气的量计算转移电子数,依据转移电子守恒,计算生成银的质量,根据消耗氢氧根计算氢离子浓度,从而计算pH。
(1)已知:H2(g)、CO(g)的燃烧热△H分别为-285.8kJmol-1、-283.0kJmol-1,18g液态水为1mol,变为水蒸气时吸热44.0kJ,则热化学方程式分别为:
①H2(g)+![]() O2(g)=H2O(1) △H=-285.8 kJ/mol
O2(g)=H2O(1) △H=-285.8 kJ/mol
②CO(g)+![]() O2(g)=CO2(g) △H=-283kJ/mol
O2(g)=CO2(g) △H=-283kJ/mol
③H2O(1)=H2O(g) △H=+44kJ/mol
根据盖斯定律,②×3+①+③可得:3CO(g)+H2(g)+2O2(g)=3CO2(g)+H2O(g)△H=-1090.8kJmol-1;该装置为燃料电池,通入燃料的一极为负极,通入氧气的一极为正极,则A为负极,B为正极,B电极上氧气和二氧化碳得电子,发生还原反应,电极反应式为2CO2+O2+4e-=2CO32-;
(2)N2O5中氮元素的化合价是+5价,而硝酸中氮元素也是+5价,若只有硝酸作电解液的电极室生成N2O5未发生氧化还原反应,由于N2O4中N为+4价,则含有N2O4的电极室电解后产生N2O5,氮元素的化合价由+4价变为+5价,发生氧化反应,该电极室作阳极,应与电源正极相连,根据(1)中分析,A为负极,因此应该在左侧生成N2O5,则左侧室应加入试剂b;其电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+;
(3)电解足量的硝酸银溶液,阳极为氢氧根失电子生成氧气,阴极上发生反应:Ag++e=Ag,产物的质量为5.4g,即![]() =0.05mol,转移电子是0.05mol,在阳极上:4OH4e=2H2O+O2↑,产生氧气的物质的量是0.0125mol,标况下的体积是0.0125mol×22.4L/mol= 0.28L,则消耗氢氧根的物质的量为0.05mol,则溶液中氢离子为0.05mol,浓度为
=0.05mol,转移电子是0.05mol,在阳极上:4OH4e=2H2O+O2↑,产生氧气的物质的量是0.0125mol,标况下的体积是0.0125mol×22.4L/mol= 0.28L,则消耗氢氧根的物质的量为0.05mol,则溶液中氢离子为0.05mol,浓度为![]() =0.1mol/L,所以溶液的pH为1。
=0.1mol/L,所以溶液的pH为1。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案