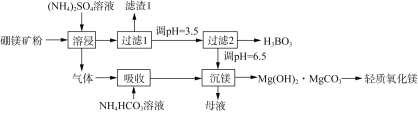
题目内容
【题目】在一定条件下,反应N2 + 3H2![]() 2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7 g,则反应速率为
2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7 g,则反应速率为
A.v(H2)=0.03 mol/(L·min)B.v(N2)=0.02mol/(L·min)
C.v(NH3)=0.01mol/(L·min)D.v(NH3)=0.17mol/(L·min)
【答案】C
【解析】
1.7g氨气的物质的量是1.7g÷17/mol=0.1mol,则氨气的浓度是0.1mol÷2L=0.05mol/L,所以氨气的反应速率是0.05mol/L÷5min=0.01 mol/(L·min),选项C正确,D不正确;又因为反应速率之比是相应的化学计量数之比,则氢气和氮气反应速率分别是0.015 mol/(L·min)和0.005 mol/(L·min),选项A、B不正确;
答案选C。

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目