题目内容
【题目】某元素的同位素![]() ,它的氯化物XCl21.11g溶于水配成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,求:
,它的氯化物XCl21.11g溶于水配成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,求:
(1)Z值和A值。
(2)X元素在周期表中的位置。
【答案】(1)20,40;(2)第四周期第IIA族
【解析】试题分析:(1)由Cl-+Ag+═AgCl↓可知,n(Cl-)=n(Ag+)=0.02L×1mol/L=0.02mol,所以n(XCl2)=0.5n(Cl-)=0.5×0.02mol=0.01mol,则M(XCl2)=1.11g÷0.01mol=111g/mol,所以XCl2相对分子质量为111,因此X的相对原子质量=111-35.5×2=40,即X的质量数为40,质子数=质量数-中子数=40-20=20,即Z=20,A=40。(2)X为Ca,位于第四周期第ⅡA族。

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
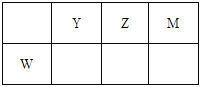
【题目】下表为元素周期表的一部分。
碳 | Y | Z | |
X | 硫 | W |
回答下列问题
(1)W元素在周期表中的位置为__________。
(2)表中元素原子半径最大的是(写元素符号)__________。
(3)写出由上表中两种元素组成,可用作制冷剂的一种化合物的电子式__________。
(4)下列事实不能说明Z元素的非金属性比S元素的非金属性强的是__________;
A.Z单质与H2S溶液反应,溶液变浑浊
B.在氧化还原反应中,1molY单质比1molS得电子多
C.Z和S两元素的简单氢化物受热分解,前者的分解温度高
(5)X与W两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式____________________。