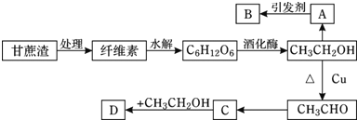
题目内容
【题目】有关短周期主族元素A、B、C、D、E、F的信息如下:
有关信息 | |
A | 其中一种核素的中子数为0 |
B | 最高价氧化物对应的水化物按1:1完全电离出电子数相等的阴、阳离子 |
C | 在地壳中的含量为第三位 |
D | 其单质在O2中燃烧,发出明亮的蓝紫色火焰 |
E | 是形成化合物种类最多的元素 |
F | 其单质常用做保护气体 |
(1)C元素是________(填元素名称),D在元素周期表中的位置是________。
(2)工业上得到C的单质常采用惰性电极电解熔融______(填化学式)的方法,C的单质可以和B的最高价氧化物的水化物发生反应,写出该反应的离子方程式:______。C形成某种化合物LiCA4既是金属储氢材料又是有机合成中的常用试剂,遇水能释放出A2,那么LiCA4中A元素的化合价为_________。
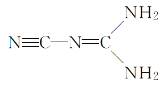
(3)在一定条件下,A与F可形成一种易溶于水的液体F2A4,其电子式为________;该物质可由NaClO与FA3反应制得,写出反应的化学方程式:_______,每生成1mol F2A4转移电子数为________。
(4)写出一个能证明E和F非金属性强弱的化学方程式________。
(5)化合物W由A、D、E、F四种元素组成。向W溶液中滴入FeCl3溶液,溶液变血红色;另取一份W溶液加入强碱溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,W的化学式为________。
(6)F的简单氢化物的沸点比它的同族相邻周期元素氢化物沸点高,理由是__________。
【答案】铝 第三周期VIA族 Al2O3 2Al+2OH- +2H2O=2AlO2- +3H2↑ -1 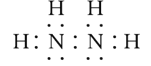 NaClO+2NH3=NaCl+N2H4+H2O 2NA NaHCO3+HNO3=NaNO3+H2O+CO2 ↑(或Na2CO3+2HNO3=2NaNO3+H2O+CO2↑) NH4SCN NH3分子间存在氢键
NaClO+2NH3=NaCl+N2H4+H2O 2NA NaHCO3+HNO3=NaNO3+H2O+CO2 ↑(或Na2CO3+2HNO3=2NaNO3+H2O+CO2↑) NH4SCN NH3分子间存在氢键
【解析】
短周期主族元素A、B、C、D、E、F,A的其中一种核素的中子数为0,是H;B的最高价氧化物对应的水化物按1:1完全电离出电子数相等的阴、阳离子,是Na;C在地壳中的含量为第三位,是Al;D单质在O2中燃烧,发出明亮的蓝紫色火焰,是S;E是形成化合物种类最多的元素,是C;F单质常用做保护气体,是N;A、B、C、D、E、F分别是H、Na、Al、S、C、N,据此分析。
(1)根据分析可知,C元素铝,D元素是S ,硫有三层电子,最外层电子数为6,D在元素周期表中的位置是第三周期第VIA族;
(2)活泼金属一般采用电解法冶炼,工业上得到C的单质常采用惰性电极电解熔融Al2O3的方法,C的单质可以和B的最高价氧化物的水化物发生反应的离子方程式:2Al+2OH- +2H2O=2AlO2- +3H2↑,LiCA4即LiAlH4,Li为+1价,Al为+3价,H为-1价,H元素的化合价为-1价;
(3)在一定条件下,A与F可形成一种易溶于水的液体F2A4,即N2H4,其电子式为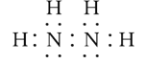 ;该物质可由NaClO与NH3反应制得,根据元素守恒,写出反应的化学方程式:NaClO+2NH3=NaCl+N2H4+H2O,N元素的化合价从-3升高到-2价,Cl元素的化合价从+1降低到-1价,每生成1mol N2H4,转移电子的物质的量为2mol,转移的电子数目为2NA;
;该物质可由NaClO与NH3反应制得,根据元素守恒,写出反应的化学方程式:NaClO+2NH3=NaCl+N2H4+H2O,N元素的化合价从-3升高到-2价,Cl元素的化合价从+1降低到-1价,每生成1mol N2H4,转移电子的物质的量为2mol,转移的电子数目为2NA;
(4)C和N位于同一周期,同周期元素的非金属性逐渐增强,N的非金属性强于C,可以用最高价氧化物对应的水化物的酸性强弱来验证,由硝酸制取碳酸,可以设计成为:NaHCO3+HNO3=NaNO3+H2O+CO2 ↑(或Na2CO3+2HNO3=2NaNO3+H2O+CO2↑);
(5)化合物W由A、D、E、F四种元素组成,即H、S、C、N,向W溶液中滴入FeCl3溶液,溶液变血红色,说明W中含有硫氰根离子;另取一份W溶液加入强碱溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,说明产生了氨气,铵根离子遇到强碱加热会产生氨气,则W中含有铵根离子,W的化学式为NH4SCN;
(6)N的电负性较强,它的氢化物是氨气,氨分子间易形成氢键,故氨气沸点比它的同族相邻周期元素氢化物沸点高;

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案