题目内容
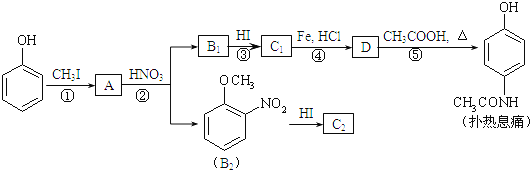
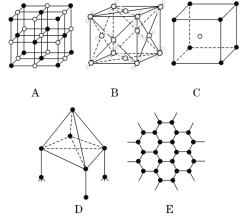
【题目】现在四种晶体,其离子排列方式如图所示,其中化学式正确的是( )
A. AB2 ![]()
B. EF2 
C. XY3Z 
D. AB3 
【答案】C
【解析】
A.此晶胞中A离子在体心,只有1个离原子,B离子在8个顶点,每个顶点参与形成8个晶胞,所以B离子也是1个,该晶体的化学式为AB,A不正确;B.此晶胞中E和F离子分别在8个顶点中的4个,E和F的离子个数比为1:1,所以该晶体的化学式为EF,B不正确;C.此晶胞中只有1个X离子在体心,Z离子在8个顶点,所以Z离子数也是1个,Y离子在6个面心,每个面心参与形成2个晶胞,所以此晶胞中有3个Y离子,X、Y、Z3种离子的个数比为1:3:1所以该晶体的化学式为XY3Z,所以C正确;D.此晶胞与NaCl晶胞相似,所以该晶体的化学式为AB,D不正确。

 阅读快车系列答案
阅读快车系列答案【题目】下表为元素周期表的一部分,a、b、c…为部分元素。回答下列问题:
a | |||||||||||||||||
b | c | d | e | ||||||||||||||
f | g | ||||||||||||||||
h | |||||||||||||||||
(1)请画出上述元素h的原子结构示意图_______;元素h位于元素周期表的第_____区。
(2)e、g两种元素的气态氢化物中更稳定的是_______(写化学式);
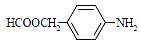
(3)b2a2分子的电子式是________ ,该分子中存在的σ键与π键的个数比为_______。
(4)c、d两种元素中第一电离能较大的是_________(写元素符号)。
(5)f和g两种元素形成的化合物是______(填“离子化合物”“共价化合物”)。a2d分子是_________分子(填极性分子或者非极性分子)。
【题目】有关短周期主族元素A、B、C、D、E、F的信息如下:
有关信息 | |
A | 其中一种核素的中子数为0 |
B | 最高价氧化物对应的水化物按1:1完全电离出电子数相等的阴、阳离子 |
C | 在地壳中的含量为第三位 |
D | 其单质在O2中燃烧,发出明亮的蓝紫色火焰 |
E | 是形成化合物种类最多的元素 |
F | 其单质常用做保护气体 |
(1)C元素是________(填元素名称),D在元素周期表中的位置是________。
(2)工业上得到C的单质常采用惰性电极电解熔融______(填化学式)的方法,C的单质可以和B的最高价氧化物的水化物发生反应,写出该反应的离子方程式:______。C形成某种化合物LiCA4既是金属储氢材料又是有机合成中的常用试剂,遇水能释放出A2,那么LiCA4中A元素的化合价为_________。
(3)在一定条件下,A与F可形成一种易溶于水的液体F2A4,其电子式为________;该物质可由NaClO与FA3反应制得,写出反应的化学方程式:_______,每生成1mol F2A4转移电子数为________。
(4)写出一个能证明E和F非金属性强弱的化学方程式________。
(5)化合物W由A、D、E、F四种元素组成。向W溶液中滴入FeCl3溶液,溶液变血红色;另取一份W溶液加入强碱溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,W的化学式为________。
(6)F的简单氢化物的沸点比它的同族相邻周期元素氢化物沸点高,理由是__________。