题目内容
20.如图所示Cu-Zn原电池,下列叙述正确的是( )
| A. | 锌为负极,发生氧化反应 | B. | 铜为负极,铜片上有气泡产生 | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 溶液中的SO42-移向正极 |
分析 原电池中,活泼金属作负极,负极发生氧化反应,正极发生还原反应,负极反应式为Zn-2e-=Zn2+,正极反应式为2H++2e-=H2↑,原电池中电子由负极流向正极,电解质溶液中阴离子移向负极,阳离子移向正极.
解答 解:A、锌铜原电中,Zn比Cu活泼作负极,失电子发生氧化反应,故A正确;
B、Cu为正极,氢离子在正极得电子生成氢气,故B错误;
C、原电池中电子由负极流向正极,电子由锌片通过导线流向铜片,故C错误;
D、电解质溶液中阴离子移向负极,所以溶液中的SO42-移向负极,故D错误;
故选A.
点评 本题考查原电池,利用氧化还原反应来分析电极反应是解答本题的关键,并熟悉工作原理来解答,难度不大.

练习册系列答案
相关题目
10.下列说法正确的是( )
| A. | 工业上可通过电解饱和食盐水制得金属钠 | |
| B. | 失去电子的物质是还原剂,还原剂发生氧化反应,表现出还原性 | |
| C. | 红热的铁丝在氯气中剧烈燃烧产生大量的白烟 | |
| D. | 干燥的氯气有漂白性,还能用作杀菌消毒剂 |
11.下列各组液体混和物,用分液漏斗不能分开的是( )
| A. | 苯和水 | B. | 乙醇和水 | C. | 乙酸乙酯和水 | D. | 硝基苯和水 |
8.某同学在试管中做铁钉与稀硫酸反应的实验,发现反应速率较慢,下列措施:
①给试管加热 ②加入铁粉 ③加入冰块
④加入少量醋酸钠晶体 ⑤将稀硫酸换为浓硫酸,
能加快反应速率的是( )
①给试管加热 ②加入铁粉 ③加入冰块
④加入少量醋酸钠晶体 ⑤将稀硫酸换为浓硫酸,
能加快反应速率的是( )
| A. | ①②⑤ | B. | ①② | C. | ③④ | D. | ③④⑤ |
5.在反应 3NO2+H2O→2HNO3+NO 中NO2的作用是( )
| A. | 氧化剂 | B. | 还原剂 | ||
| C. | 既是氧化剂又是还原剂 | D. | 既不是氧化剂又不是还原剂 |
12.下列变化中,可逆性最不明显的是( )
| A. | NH3+H2O→NH3•H2O | B. | H2+I2→2HI | ||
| C. | HClO→H++ClO- | D. | Cl2+2NaOH→NaCl+NaClO+H2O |
9.下列物质中,含有极性共价键的离子化合物是( )
| A. | MgO | B. | NaCl | C. | NaOH | D. | H2O2 |
10.某学生对SO2与漂粉精的反应进行实验探究:
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
(2)pH试纸颜色的变化说明漂粉精溶液具有的化学性质是碱性;漂白性.
(3)用离子方程式解释现象ⅲ中黄绿色褪去的原因Cl2+SO2+2H2O=4H++2Cl-+SO42-.
| 操 作 | 现 象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
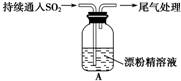 | ⅰ.液面上方出现白雾; ⅱ.稍后,出现浑浊,溶液变为黄绿色; ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
(2)pH试纸颜色的变化说明漂粉精溶液具有的化学性质是碱性;漂白性.
(3)用离子方程式解释现象ⅲ中黄绿色褪去的原因Cl2+SO2+2H2O=4H++2Cl-+SO42-.
 (11)
(11) (12)
(12)