题目内容
A、B、C、D、E 五种短周期主族元素分占三个周期,A、B、C为同一周期依次相邻的3种元素,A和C的原子序数之比为3:4,E原子的电子层数等于最外层电子数,D的原子序数小于E.请用化学用语回答相关问题:
(1)A元素在周期表中的位置
(2)比较C和E简单离子半径大小:
(3)元素E的一种常见的可溶性盐溶液呈碱性,其原因是(用离子方程式表示):
(4)X、Y、Z、甲、乙、丙是由A、B、C分别与D形成的化合物,六种化合物可以排成下表,其中同一横行的分子中电子数相同,同一纵行的物质所含元素种类相同,其中X、Y、甲常温常压下为气体,Z、乙、丙常温常压下为液体.
①若甲的电子数与CH3OH相同,则甲的分子式为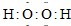
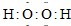 .
.
②乙的分子式为B2D4,乙和丙常作火箭推进器的燃料,反应后的产物无污染.已知8g液态乙与足量液态丙完全反应,产物均为气体时,放出热量为160.35kJ,试写出该反应的热化学方程式:
(1)A元素在周期表中的位置
第二周期ⅣA族
第二周期ⅣA族
.(2)比较C和E简单离子半径大小:
O2->Al3+
O2->Al3+
.(3)元素E的一种常见的可溶性盐溶液呈碱性,其原因是(用离子方程式表示):
A1O2-+2H2O?Al(OH)3+OH-
A1O2-+2H2O?Al(OH)3+OH-
;| X | Y | Z |
| 甲 | 乙 | 丙 |
①若甲的电子数与CH3OH相同,则甲的分子式为
C2H6
C2H6
;丙的电子式为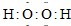
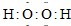
②乙的分子式为B2D4,乙和丙常作火箭推进器的燃料,反应后的产物无污染.已知8g液态乙与足量液态丙完全反应,产物均为气体时,放出热量为160.35kJ,试写出该反应的热化学方程式:
N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=-641.40kJ/mol
N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=-641.40kJ/mol
.分析:A、B、C、D、E 五种短周期主族元素分占三个周期,A、B、C为同一周期依次相邻的3种元素,A和C的原子序数之比为3:4,则A为C,B为N,C为O;E原子的电子层数等于最外层电子数,D的原子序数小于E,E为第三周期第ⅢA族元素,为Al,则D为H符合题意,然后结合元素及其单质、化合物的性质及化学用语来解答.
解答:解:A、B、C、D、E 五种短周期主族元素分占三个周期,A、B、C为同一周期依次相邻的3种元素,A和C的原子序数之比为3:4,则A为C,B为N,C为O;E原子的电子层数等于最外层电子数,D的原子序数小于E,E为第三周期第ⅢA族元素,为Al,则D为H符合题意,
(1)由上述分析可知,A为C,则位于第二周期ⅣA族,故答案为:第二周期ⅣA族;
(2)C和E简单离子具有相同的电子排布,原子序数大的离子半径小,则离子半径为O2->Al3+,故答案为:O2->Al3+;
(3)元素E的一种常见的可溶性盐溶液呈碱性,盐为强碱对应的偏铝酸盐,水解显碱性,离子反应为A1O2-+2H2O?Al(OH)3+OH-,故答案为:A1O2-+2H2O?Al(OH)3+OH-;
(4)同一纵行的物质所含元素种类相同,其中X、Y、甲常温常压下为气体,Z、乙、丙常温常压下为液体.
X为CH4,Y为NH3,Z为H2O,则甲为C2H6,乙为N2H4,丙为H2O2,
①甲的电子数与CH3OH相同,则电子数为18,所以甲为乙烯,分子式为C2H6;同一横行的分子中电子数相同,丙为H2O2,电子式为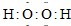 ,
,
故答案为:C2H6;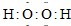 ;
;
②8g液态乙与足量液态丙完全反应,产物均为气体时,放出热量为160.35kJ,则1mol乙反应放出的热量为
=640.40kJ,则热化学方程式为N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=-641.40kJ/mol,故答案为:N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=-641.40kJ/mol.
(1)由上述分析可知,A为C,则位于第二周期ⅣA族,故答案为:第二周期ⅣA族;
(2)C和E简单离子具有相同的电子排布,原子序数大的离子半径小,则离子半径为O2->Al3+,故答案为:O2->Al3+;
(3)元素E的一种常见的可溶性盐溶液呈碱性,盐为强碱对应的偏铝酸盐,水解显碱性,离子反应为A1O2-+2H2O?Al(OH)3+OH-,故答案为:A1O2-+2H2O?Al(OH)3+OH-;
(4)同一纵行的物质所含元素种类相同,其中X、Y、甲常温常压下为气体,Z、乙、丙常温常压下为液体.
X为CH4,Y为NH3,Z为H2O,则甲为C2H6,乙为N2H4,丙为H2O2,
①甲的电子数与CH3OH相同,则电子数为18,所以甲为乙烯,分子式为C2H6;同一横行的分子中电子数相同,丙为H2O2,电子式为
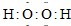 ,
,故答案为:C2H6;
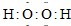 ;
;②8g液态乙与足量液态丙完全反应,产物均为气体时,放出热量为160.35kJ,则1mol乙反应放出的热量为
| 160.35kJ | ||
|
点评:本题考查位置、结构、性质的关系及应用,元素的推断是解答的关键,注意“短周期”“三个周期”等信息综合考虑来推断元素,(4)为解答的难点,熟悉10电子和18电子微粒即可解答,题目难度中等.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.