题目内容
17.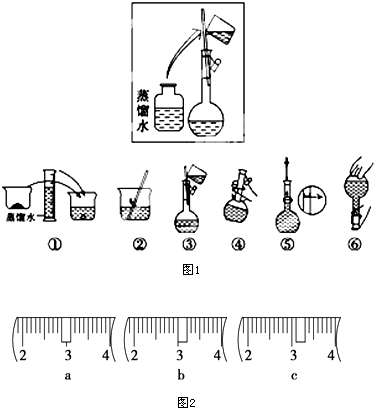 某同学帮助水质检测站配制230mL、1mol•L-1NaOH溶液以备使用.
某同学帮助水质检测站配制230mL、1mol•L-1NaOH溶液以备使用.(1)该同学应选择250mL的容量瓶.
(2)其操作步骤如图1所示,则如图操作应在下图中的C(填选项字母)之间.
A.②与③B.①与②C.④与⑤
(3)该同学应称取NaOH固体10.0g,用质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小cd(填字母),并在图2中选出能正确表示游码位置的选项c(填字母).
附表:砝码规格
| a | b | c | d | e | |
| 砝码大小/g | 100 | 50 | 20 | 10 | 5 |
①称量NaOH的时间太长偏小.
②容量瓶中原来有少量蒸馏水,浓度会无影响.
③NaOH溶液未冷却至室温就转移到容量瓶偏大.
④转移完溶液后未洗涤玻璃棒和烧杯,浓度会偏小.
⑤定容时俯视刻度偏大.
⑥定容摇匀后发现溶液凹面低于刻度线,再补加少量蒸馏水至刻度线,浓度会偏小.
分析 (1)选取容量瓶的规格应该等于或稍大于配制溶液的体积;
(2)如图所示的操作为移液洗涤后向容量瓶内加水,应在加水振荡与定容之间;
(3)根据m=cVM计算所需的氢氧化钠的质量;依据氢氧化钠的质量选择合适的砝码,游码应在3.1g的位置;
(4)分析操作对溶质的物质的量、溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制230mL、1mol•L-1NaOH溶液,应选择250ml容量瓶;
故答案为:250;
(2)如图所示的操作为移液洗涤后向容量瓶内加水,应在转移与定容之间,即应在③和④之间,
故选:C;
(3)配制230mL、1mol•L-1NaOH溶液,应选择250ml容量瓶,实际配制250ml溶液,需要氢氧化钠的质量=0.25L×1mol/L×40g/mol=10.0g;氢氧化钠具有腐蚀性且易潮解,应放在烧杯内称量,根据氢氧化钠与烧杯总质量为10.0g+23.1g=33.1g,砝码应选择20g、10g,游码应在3.1g的位置,
故选:cd;c;
(4)①称量NaOH的时间太长,导致氢氧化钠吸收空气中的水和二氧化碳,实际称量的溶质的物质的量偏小,溶液的浓度偏小;
故答案为:偏小;
②容量瓶中原来有少量蒸馏水,对溶质的物质的量和溶液的体积都不会产生影响,溶液的浓度无影响;
故答案为:无影响;
③NaOH溶液未冷却至室温就转移到容量瓶,冷却后液面下降,导致溶液的体积偏小,溶液的浓度偏大,
故答案为:偏大;
④转移完溶液后未洗涤玻璃棒和烧杯,导致溶质的物质的量偏小,溶液的浓度偏小,
故答案为:偏小;
⑤定容时俯视刻度,导致溶液的体积偏小,溶液的浓度偏大,
故答案为:偏大;
⑥定容摇匀后发现溶液凹面低于刻度线,再补加少量蒸馏水至刻度线,导致溶液的体积偏大,溶液的浓度偏小,
故答案为:偏小.
点评 本题考查一定物质的量浓度溶液的配制和误差分析,熟悉配制原理和过程、熟悉容量瓶规格的选择、托盘天平的使用方法即可解答,题目难度不大.

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案| A. | 铝与氢氧化钠反应 | |
| B. | 向氯化铝溶液中加入过量氨水 | |
| C. | 含氟牙膏中加入氯化铝并不断充分搅拌 | |
| D. | 向硫酸铜溶液中通入过量氨气 |
| A. | 中和热(△H)的测定中,若使用简易装置时在大小烧杯之间没有垫碎泡沫塑料(或纸条) | |
| B. | 用标准盐酸滴定氢氧化钠溶液,酸式滴定管洗净后,没有用标准盐酸润洗,所测出的碱液的浓度值 | |
| C. | 食醋总酸含量测定实验中,用移液管移取食醋体积时视线俯视标准线移液 | |
| D. | 在镀锌铁皮的锌镀层厚度的测定中,锌在酸中溶解后没有及时取出 |

| A. | 分子中含有2种官能团 | |
| B. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 | |
| C. | 1mol分枝酸最多可与3molNaOH发生中和反应 | |
| D. | 可与乙醇、乙酸反应,且反应类型相同 |
| A. | 标准状况下,22.4L SO3的分子数为1NA | |
| B. | 3.9g Na2O2固体中阴离子的数目为0.1NA | |
| C. | 1mol Cl2与1mol Fe反应,转移的电子数为2NA | |
| D. | 0.1molN2和C18O含有的中子数均为1.4NA |
| A. | FeBr3作催化剂,苯和溴水发生反应可生成无色、比水重的液体溴苯 | |
| B. | 将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,实现乙醇被氧化为乙醛的实验 | |
| C. | 使用AgNO3溶液验证三氯甲烷中是否含有氯元素,现象是产生白色沉淀 | |
| D. | 可以用水鉴别硝基苯、乙醇、四氯化碳三种有机物 |
| A. | 蔗糖炭化 | B. | 煤的气化 | C. | 石油裂化 | D. | 氨的液化 |
| A. | 甲烷 | B. | 乙烯 | C. | 苯 | D. | 二氧化硫 |