题目内容
6.某饱和一元羧酸和饱和一元醇所生成的酯A 1.48g与30mL 1mol/L的NaOH溶液在加热下反应,待反应完全后,反应后的混合物中剩余的NaOH需用40mL 0.25mol/L盐酸才能刚好中和.(1)求A的分子式;
(2)写出A可能的结构简式.
分析 题中涉及反应有RCOOR'+H2O→RCOOH+R'OH,NaOH+HCl=NaCl+H2O,n(NaOH)=0.03L×1mol/L=0.03mol,n(HCl)=0.04L×0.25mol/L=0.01mol,结合反应的方程式计算.
解答 解:(1)由RCOOR'+H2O→RCOOH+R'OH,NaOH+HCl=NaCl+H2O可知,n(酯)=0.03L×1mol/L-0.04L×0.25mol/L═O.O2mol,
M(酯)═$\frac{1.48g}{0.02mol}$=74g/mol,
则有机物分子式为:C3H6O2,
答:有机物分子式为C3H6O2;
(2)A为酯,分子式为C3H6O2,则可能结构为:HCOOCH2CH3,CH3COOCH3.
答:A可能的结构简式为HCOOCH2CH3,CH3COOCH3.
点评 本题考查机物的分子式的确定,为高频考点,侧重于学生的分析、计算能力的考查,注意把握酯化反应的特点,结合反应的方程式计算该题,难度中等.

练习册系列答案
相关题目
16.下列物质所属类别不正确的是( )
| A. | 纯碱--碱 | B. | 氯化铝--盐 | ||
| C. | 金属钠--还原剂 | D. | 二氧化硅--酸性氧化物 |
17.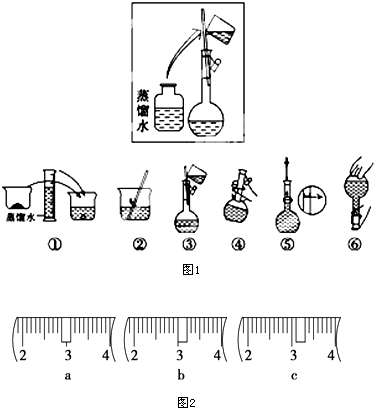 某同学帮助水质检测站配制230mL、1mol•L-1NaOH溶液以备使用.
某同学帮助水质检测站配制230mL、1mol•L-1NaOH溶液以备使用.
(1)该同学应选择250mL的容量瓶.
(2)其操作步骤如图1所示,则如图操作应在下图中的C(填选项字母)之间.
A.②与③B.①与②C.④与⑤
(3)该同学应称取NaOH固体10.0g,用质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小cd(填字母),并在图2中选出能正确表示游码位置的选项c(填字母).
附表:砝码规格
(4)下列实验操作对实验结果有何影响(填偏大、偏小或无影响)
①称量NaOH的时间太长偏小.
②容量瓶中原来有少量蒸馏水,浓度会无影响.
③NaOH溶液未冷却至室温就转移到容量瓶偏大.
④转移完溶液后未洗涤玻璃棒和烧杯,浓度会偏小.
⑤定容时俯视刻度偏大.
⑥定容摇匀后发现溶液凹面低于刻度线,再补加少量蒸馏水至刻度线,浓度会偏小.
 某同学帮助水质检测站配制230mL、1mol•L-1NaOH溶液以备使用.
某同学帮助水质检测站配制230mL、1mol•L-1NaOH溶液以备使用.(1)该同学应选择250mL的容量瓶.
(2)其操作步骤如图1所示,则如图操作应在下图中的C(填选项字母)之间.
A.②与③B.①与②C.④与⑤
(3)该同学应称取NaOH固体10.0g,用质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小cd(填字母),并在图2中选出能正确表示游码位置的选项c(填字母).
附表:砝码规格
| a | b | c | d | e | |
| 砝码大小/g | 100 | 50 | 20 | 10 | 5 |
①称量NaOH的时间太长偏小.
②容量瓶中原来有少量蒸馏水,浓度会无影响.
③NaOH溶液未冷却至室温就转移到容量瓶偏大.
④转移完溶液后未洗涤玻璃棒和烧杯,浓度会偏小.
⑤定容时俯视刻度偏大.
⑥定容摇匀后发现溶液凹面低于刻度线,再补加少量蒸馏水至刻度线,浓度会偏小.
14.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列事实不能说明上述观点的是( )
| A. | 甲苯能使酸性高锰酸钾溶液褪色,苯不能使酸性高锰酸钾溶液褪色 | |
| B. | 发生硝化反应时,苯需要加热,甲苯在常温下就能进行 | |
| C. | 苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 | |
| D. | 乙烯能发生加成反应,乙烷不能发生加成反应 |
1.下列物质中,属于共价化合物的是( )
| A. | MgF2 | B. | NaCl | C. | NH3 | D. | H2 |
11.Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g)在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
(1)716K时,可以表示可逆反应2HI(g)?H2(g)+I2(g)达到平衡的标志是AG.
A.碘化氢的生成速率和分解速率相等
B.单位时间内,1molH-H键生成,同时有2molH-I断开.
C.恒容的容器中,气体密度保持不变
D.恒容的容器中,压强保持不变
E.c(H2)和c(I2)的浓度相等
F.容器内气体的平均分子量保持不变
G.容器内气体颜色保持不变
(2)根据上述实验结果,该反应的平衡常数K的计算式为:$\frac{0.10{8}^{2}}{0.78{4}^{2}}$.(用表中具体数值代入,不计算结果)
(3)上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中
k正、k逆为速率常数,则k逆为$\frac{{k}_{正}}{K}$(以K和k正表示).若k正=0.0027min-1,在t=40min时,v正=1.95×10-3min-1.
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
A.碘化氢的生成速率和分解速率相等
B.单位时间内,1molH-H键生成,同时有2molH-I断开.
C.恒容的容器中,气体密度保持不变
D.恒容的容器中,压强保持不变
E.c(H2)和c(I2)的浓度相等
F.容器内气体的平均分子量保持不变
G.容器内气体颜色保持不变
(2)根据上述实验结果,该反应的平衡常数K的计算式为:$\frac{0.10{8}^{2}}{0.78{4}^{2}}$.(用表中具体数值代入,不计算结果)
(3)上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中
k正、k逆为速率常数,则k逆为$\frac{{k}_{正}}{K}$(以K和k正表示).若k正=0.0027min-1,在t=40min时,v正=1.95×10-3min-1.
9.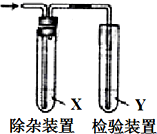 用如图所示装置检验气体时试剂X没必要或是错误的是( )
用如图所示装置检验气体时试剂X没必要或是错误的是( )
 用如图所示装置检验气体时试剂X没必要或是错误的是( )
用如图所示装置检验气体时试剂X没必要或是错误的是( )| 检验的气体 | 试剂X | 试剂Y | |
| A | CH3CH2Br与NaOH乙醇溶液共热制备的乙烯 | H2O | Br2的CCl4溶液 |
| B | CH3CH2OH与浓H2SO4共热170℃制备的乙烯 | NaOH溶液 | 酸性KMnO4溶液 |
| C | 电石与饱和食盐水反应制备的乙烯 | 水 | 酸性KMnO4溶液 |
| D | 苯,液溴,铁屑混合反应生成的HBr | CCl4 | 硝酸银溶液 |
| A. | A | B. | B | C. | C | D. | D |

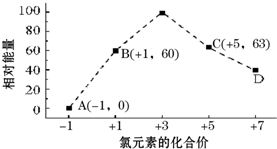 元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.