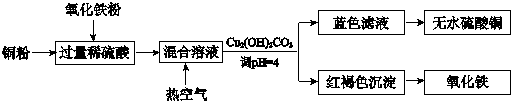
题目内容
10.根据理论研究,元素周期表可容纳164种元素.理论上164号、114号、14号元素位于同一主族.根据你所学知识,下列有关预测肯定不正确的是( )| A. | 164号元素是金属元素 | |
| B. | 164号元素位于ⅣA族 | |
| C. | 164号元素对应的最高价氧化物的水化物其碱性比114号的强 | |
| D. | 164号元素存在稳定的气态氢化物,且还原性比SiH4弱 |
分析 164号、114号、14号元素位于同一主族,原子核外最外层电子数为4,位于ⅣA族,结合同主族元素的性质的递变规律解答该题.
解答 解:A.同周期元素从上到下金属性逐渐增强,由非金属到金属递变,164号元素为金属元素,故A正确;
B.164号、114号、14号元素位于同一主族,原子核外最外层电子数为4,位于ⅣA族,故B正确;
C.同主族元素从上到下金属性逐渐增强,则164号元素对应的最高价氧化物的水化物其碱性比114号的强,故C正确;
D.164号元素为金属元素,不存在气态氢化物,故D错误.
故选D.
点评 本题考查元素及化合物的性质,把握同主族元素性质的相似性和递变性为解答的关键,本题注意利用类推的方法思考,题目难度不大.

练习册系列答案
相关题目
1.下列说法中错误的是( )
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 在共价化合物中一定含有共价键 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 离子化合物中可能含有共价键 |
18.已知中和热的数值是57.3kJ•mol-1.下列物质反应时,产生57.3kJ热量的是( )
| A. | 稀HCl和稀NaOH | |
| B. | 1.0 mol•L-1 HCl和1.0 mol•L-1 NaOH | |
| C. | 500 mL 2.0 mol•L-1 HCl和500 mL2.0 mol•L-1 NaOH | |
| D. | 500 mL 2.0 mol•L-1 H2SO4和500 mL 2.0 mol•L-1 Ba(OH)2 |
15.下列说法正确的是( )
| A. | 用活性炭去除冰箱中的异味是发生了化学反应 | |
| B. | 用热碱水清除炊具上残留的油污,是因为Na2CO3可直接和油污反应 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土保存水果 | |
| D. | 漂白粉在空气中久置变质是因为漂白粉中的CaCl2 与空气中的CO2反应生成CaCO3 |
19.将标准状况下密度为ρ的a L HCl(g)溶于1000g水中,得到盐酸的密度为b g/cm3,则该盐酸的物质的量浓度是( )
| A. | $\frac{ρ}{22.4}$ mol/L | B. | $\frac{ab}{22400}$ mol/L | ||
| C. | $\frac{ab}{22400+36.5a}$ mol/L | D. | $\frac{1000ab}{22400+36.5a}$ mol/L |
11.下列说法正确的是( )
| A. | Na与H2O的反应是熵增的放热反应,该反应能自发进行 | |
| B. | 0.1 mol AgCl和0.1mol AgI混合后加入1 L水中,所得溶液中c(Cl-)=c(I-) | |
| C. | pH=9的CH3COONa溶液和pH=9的NH3•H2O溶液,两溶液中水的电离程度相同 | |
| D. | 25℃时,0.1mol•L-1的硫化氢溶液与等浓度的硫化钠溶液的导电能力相当 |
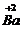 CO3;③三个钙原子3Ca.
CO3;③三个钙原子3Ca.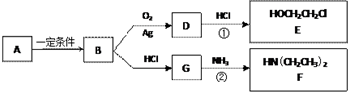
 )
)

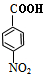 +HOCH2CH2Cl$→_{△}^{浓硫酸}$
+HOCH2CH2Cl$→_{△}^{浓硫酸}$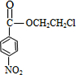 +H2O
+H2O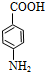
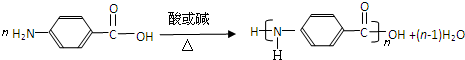
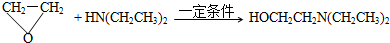 .
.