题目内容
9.某温度下气体反应达到化学平衡,平衡常数K=$\frac{c(A)•c2(B)}{c2(E)•c(F)}$,恒容时,若温度适当降低,F的浓度增加.下列说法中正确的是( )| A. | 增大c(A)、c(B),K增大 | |
| B. | 降低温度,正反应速率增大 | |
| C. | 该反应的焓变为负值 | |
| D. | 该反应的化学方程式为2E(g)+F(g)?A(g)+2B(g) |
分析 某温度下气体反应达到化学平衡,平衡常数K=$\frac{c(A)c{\;}^{2}(B)}{c{\;}^{2}(E)c(F)}$,则该反应为2E(g)+F(g)?A(g)+2B(g),恒容时,若温度适当降低,F的浓度增加,平衡向正反应方向移动,正反应为吸热反应.平衡常数只受温度影响,与浓度无关,降低温度正、逆反应速率都降低,据此解答.
解答 解:某温度下气体反应达到化学平衡,平衡常数K=$\frac{c(A)c{\;}^{2}(B)}{c{\;}^{2}(E)c(F)}$,则该反应为2E(g)+F(g)?A(g)+2B(g),恒容时,若温度适当降低,F的浓度增加,平衡向正反应方向移动,正反应为吸热反应,
A.平衡常数只受温度影响,与浓度无关,温度不变,平衡常数不变,故A错误;
B.降低温度,正、逆反应速率都降低,逆反应速率降低更多,平衡向正反应方向移动,故B错误;
C.正反应为吸热反应,焓变为正值,故C错误;
D.平衡常数K=$\frac{c(A)c{\;}^{2}(B)}{c{\;}^{2}(E)c(F)}$,则该反应为2E(g)+F(g)?A(g)+2B(g),故D正确;
故选D.
点评 本题考查化学平衡常数、化学平衡影响因素等,难度中等,根据平衡常数表达式书写反应是解题关键.

练习册系列答案
相关题目
17.与主族元素在元素周期表中所处位置有关的是( )
| A. | 相对原子质量 | B. | 电子层数和最外层电子数 | ||
| C. | 化合价 | D. | 核内中子数 |
14.能够鉴定氯乙烷中存在氯元素的操作是( )
| A. | 在氯乙烷中直接加入AgNO3溶液 | |
| B. | 在氯乙烷中加蒸馏水,然后加入AgNO3溶液 | |
| C. | 在氯乙烷中加入乙醇,加热后酸化,然后加入AgNO3溶液 | |
| D. | 在氯乙烷中加入NaOH溶液,加热后酸化,然后加入AgNO3溶液 |
1.下列说法中错误的是( )
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 在共价化合物中一定含有共价键 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 离子化合物中可能含有共价键 |
18.已知中和热的数值是57.3kJ•mol-1.下列物质反应时,产生57.3kJ热量的是( )
| A. | 稀HCl和稀NaOH | |
| B. | 1.0 mol•L-1 HCl和1.0 mol•L-1 NaOH | |
| C. | 500 mL 2.0 mol•L-1 HCl和500 mL2.0 mol•L-1 NaOH | |
| D. | 500 mL 2.0 mol•L-1 H2SO4和500 mL 2.0 mol•L-1 Ba(OH)2 |
19.将标准状况下密度为ρ的a L HCl(g)溶于1000g水中,得到盐酸的密度为b g/cm3,则该盐酸的物质的量浓度是( )
| A. | $\frac{ρ}{22.4}$ mol/L | B. | $\frac{ab}{22400}$ mol/L | ||
| C. | $\frac{ab}{22400+36.5a}$ mol/L | D. | $\frac{1000ab}{22400+36.5a}$ mol/L |
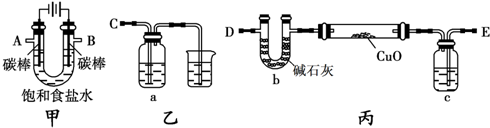
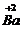 CO3;③三个钙原子3Ca.
CO3;③三个钙原子3Ca. )与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
)与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案: