题目内容
15.在研究金矿床物质组分的过程中,通过分析发现了Cu-Ni-Zn-Sn-Fe多金属互化物.(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于晶体(填“晶体”或“非晶体”),可通过X-射线衍射实验方法鉴别.
(2)基态Ni2+的核外电子排布式1s22s22p63s23p63d8;配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4属于分子晶体;Ni2+和Fe2+的半径分别为69pm和78pm,则熔点NiO>FeO(填“<”或“>”).
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2分子中含有σ键的数目为5NA;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键;写出一种与SCN-互为等电子体的分子CO2(用化学式表示).
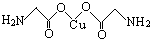
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为sp3、sp2.
(5)立方NiO(氧化镍)晶体的结构如图-1所示,其晶胞边长为apm,列式表示NiO晶体的密度为$\frac{4×74.7}{(a×1{0}^{-10})^{3}×{N}_{A}}$g/cm3(不必计算出结果,阿伏加德罗常数的值为NA).人工制备的NiO晶体中常存在缺陷(如图-2):
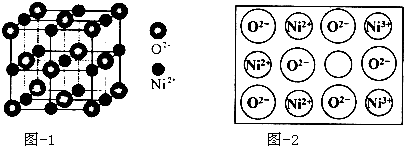
一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化.已知某氧化镍样品组成Ni0.96O,该晶体中Ni3+与Ni2+的离子个数之比为1:11.
分析 (1)晶体具有自范性,原子在三维空间里呈周期性有序排列,可通过X-射线衍射实验进行鉴别;
(2)Ni元素原子核外电子数为28,核外电子排布式为1s22s22p63s23p63d84s2,失去4s能级2个电子形成Ni2+;
配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4属于分子晶体;
离子所带电荷相同,离子半径越小,离子键越强,晶体的熔点越高;
(3)(SCN)2的结构式为N≡C-S-S-C≡N,根据[(SCN)2]的结构可知分子中有3个单键和2个碳氮三键,单键为σ键,三键含有1个σ键、2个π键;
由于异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键,所以硫氰酸(H-S-C≡N)的沸点低于异硫氰酸;
原子总数相同、价电子总数相同的微粒互为等电子体;
(4)分子中连接氨基的C原子形成2个C-H键、1个C-N、1个C-O键,没有孤电子对,而碳氧双键中的C原子形成3个σ键,没有孤电子对;
(5)根据均摊法计算晶胞中Ni、O原子数目,进而计算晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度;
根据电荷守恒计算Ni3+与Ni2+的离子个数之比.
解答 解:(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该计算互化物属于晶体,可通过X-射线衍射实验进行鉴别,
故答案为:晶体;X-射线衍射实验;
(2)Ni元素原子核外电子数为28,核外电子排布式为1s22s22p63s23p63d84s2,失去4s能级2个电子形成Ni2+,故Ni2+离子核外电子排布为:1s22s22p63s23p63d8,
Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,固态Ni(CO)4属于分子晶体;
Ni2+和Fe2+的离子所带电荷相同,Ni2+离子半径较小,NiO中离子键更强,NiO晶体的熔点更高,
故答案为:1s22s22p63s23p63d8;分子;>;
(3)(SCN)2的结构式为N≡C-S-S-C≡N,根据[(SCN)2]的结构可知分子中有3个单键和2个碳氮三键,单键为σ键,三键含有1个σ键、2个π键,(SCN)2分子含有5个σ键,故1mol(SCN)2分子中含有σ键的数目为 5NA;
由于异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键,所以硫氰酸(H-S-C≡N)的沸点低于异硫氰酸;
一种与SCN-互为等电子体的分子有CO2等,原子数相同,价电子数均为16,
故答案为:5NA;异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键;CO2;
(4)分子中连接氨基的C原子形成2个C-H键、1个C-N、1个C-O键,没有孤电子对,杂化轨道数目为4,采取sp3杂化,而碳氧双键中的C原子形成3个σ键,没有孤电子对,杂化轨道数目为3,采取sp2杂化,
故答案为:sp3、sp2;
(5)晶胞中Ni原子数目为1+12×$\frac{1}{4}$=4,氧原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量为4×$\frac{16+58.7}{{N}_{A}}$g,晶胞边长为apm,晶胞体积为(a×10-10 cm)3,NiO晶体的密度为为4×$\frac{16+58.7}{{N}_{A}}$g÷(a×10-10 cm)3=$\frac{4×74.7}{(a×1{0}^{-10})^{3}×{N}_{A}}$g/cm3;
设1mol Ni0.96O中含Ni3+xmol,Ni2+为(0.96-x)mol,根据晶体仍呈电中性,可知 3x+2×(0.96-x)=2×1,x=0.08mol Ni2+为(0.96-x)mol=0.88mol,即离子数之比为Ni3+:Ni2+=0.08:0.88=1:11,
故答案为:$\frac{4×74.7}{(a×1{0}^{-10})^{3}×{N}_{A}}$;1:11.
点评 本题是对物质结构的考查,涉及晶体结构与性质、核外电子排布、化学键、杂化轨道、晶胞计算等,难度中等,(5)为易错点,注意利用均摊法计算晶胞质量,根据阴阳离子所带电荷相等计算氧化镍晶体中离子数目之比.

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案| A. | 7:17 | B. | 3:2 | C. | 12:1 | D. | 7:1 |
| A. | 用饱和氯化铵溶液可以清洗金属表面的锈 | |
| B. | NOx、Cl2、PM2.5颗粒都会导致酸雨 | |
| C. | 在食品袋中放入盛有硅胶的透气小袋,可防止食物受潮 | |
| D. | 人体摄入大量铝盐易患“老年性痴呆”,明矾不宜大量作净水剂 |
| A. | 铝热剂用于焊接钢轨 | B. | 过氧化钠用于呼吸面具供氧 | ||
| C. | 湿润红色石蕊试纸检验氨气 | D. | 湿润的淀粉碘化钾试纸检验氯气 |
| A. | 纸上层析法 | B. | 萃取分液法 | C. | 结晶法 | D. | 蒸馏法 |
 .
. .
.