题目内容
3.下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题: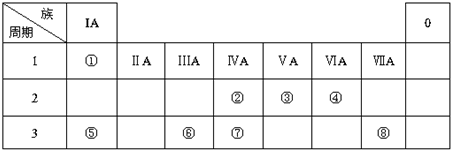
(1)④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O.
(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是HClO4>H2CO3>H2SiO3.
(3)④、⑤可形成既含离子键又含非极性共价键的某化合物,写出这种化合物的电子式:
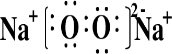 .
.
分析 由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl,
(1)电子层越多半径越大,电子层相同时核电荷数越大半径越小;
(2)非金属性越强,最高价含氧酸的酸性越强;
(3)④、⑤可形成既含离子键又含非极性共价键的某化合物为Na2O2.
解答 解:由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl,
(1)电子层越多半径越大,所以Na、Al>O,电子层一样多的原子,核电荷数越多半径越小,即Na>Al,故答案为:Na>Al>O;
(2)非金属性Cl>C>Si,则最高价含氧酸的酸性由强到弱的顺序是HClO4>H2CO3>H2SiO3,故答案为:HClO4>H2CO3>H2SiO3;
(3)④、⑤可形成既含离子键又含非极性共价键的某化合物为Na2O2,其电子式为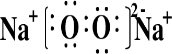 ,故答案为:
,故答案为: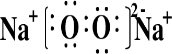 .
.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、元素化合物性质为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.

练习册系列答案
相关题目
13.下列对碱金属性质的叙述中,正确的是( )
①都是银白色的柔软金属(除铯外),密度都比较小
②单质在空气中燃烧生成的都是过氧化物
③碱金属单质都与水剧烈反应
④单质的熔、沸点随着原子序数的增加而升高.
①都是银白色的柔软金属(除铯外),密度都比较小
②单质在空气中燃烧生成的都是过氧化物
③碱金属单质都与水剧烈反应
④单质的熔、沸点随着原子序数的增加而升高.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
14.下列说法中,正确的是( )
| A. | 治理“地沟油”,可通过水解反应制得肥皂 | |
| B. | 硅晶体具有半导体性能,可用于制取光导纤维 | |
| C. | 人类超量碳排放及氮氧化物和二氧化硫的排放是形成酸雨的主要原因 | |
| D. | PM2.5是指空气中直径≤2.5 μm的颗粒物,直径为2.5 μm的颗粒物分散在空气中形成胶体 |
18.从海水中提取金属镁的生产步骤有:①浓缩结晶 ②加熟石灰 ③加盐酸 ④过滤 ⑤熔融电解,正确的生产顺序是( )
| A. | ①②③④⑤ | B. | ⑤④③①② | C. | ②④③①⑤ | D. | ③④②①⑤ |
8.取1 mol A和a mol B使其发生反应 A(g)+aB(g)?bC(g),当反应达到平衡时,A的转化率为50%,在同温、同压下测得混合气体的密度是原来的$\frac{4}{3}$倍,则a、b可能是( )
| A. | a=1,b=4 | B. | a=3,b=3 | C. | a=2,b=3 | D. | a=3,b=2 |
15.下列化合物在核磁共振氢谱中能出现两组峰,且其峰面积之比为3:2的是( )
| A. | 对二甲苯 | B. | 乙烷 | C. | 乙醇 | D. | 萘(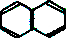 ) ) |
12. 一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)=AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )
一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)=AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )
 一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)=AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )
一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)=AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )| A. | 光照时,电流由Y流向X | |
| B. | 光照时,Pt电极发生的反应为2Cl-+2e-=Cl2 | |
| C. | 光照时,Cl-向Ag电极移动 | |
| D. | 光照时,电池总反应为:AgCl(s)+Cu+(aq)$\frac{\underline{\;光\;}}{\;}$Ag (s)+Cu2+(aq)+Cl-(aq) |
13.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,22.4 L乙烯中含C-H键的数目为4NA | |
| B. | 0.1 mol•L-1的(NH4)2SO4溶液中含有阳离子的总数为0.2NA | |
| C. | 7.8 g Na2S固体和7.8 g Na2O2固体中含有的阴离子数目均为0.1NA | |
| D. | 标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |