题目内容
【题目】向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)CH3OH(g)△H<0.L(L1、L2)、X可分别代表压强或温度,如图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系.下列说法中,正确的是( ) 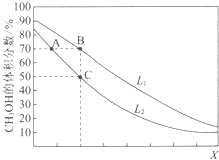
A.X代表压强
B.L1<L2
C.平衡常数:K(A)=K(B)
D.在C点时,CO转化率为75%
【答案】D
【解析】解:A、反应CO(g)+2H2(g)CH3OH(g),增大压强,甲醇的体积分数应该是增加的,所以X不能代表压强,故A错误;
B、升高温度,甲醇的体积分数减小,所以X表示温度,增大压强,甲醇的体积分数应该是增加的,L表示压强,L1>L2,故B错误;
C、化学平衡常数只受温度的影响,升高温度,甲醇的体积分数减小,所以X表示温度,A、B温度不同,所以K不同,故C错误;
D、在C点时,设CO转化的量是x,则
CO(g)+ | 2H2(g) | CH3OH(g) | |
起始量 | n | 2n | 0 |
转化量 | x | 2x | x |
平衡量 | n-x | 2n-2x | x |
甲醇的体积分数是50%,此时 ![]() =50%,解得x=0.75n,CO转化率为75%,故D正确.
=50%,解得x=0.75n,CO转化率为75%,故D正确.
故选D.

【题目】下列实验操作和现象对应的结论错误的是
选项 | 实验操作和现象 | 结论 |
A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO32- |
B |
| 反应结束后,锥形瓶中溶液的溶质是CuSO4,集气瓶中收集到的气体是NO |
C | 向1mL浓度均为0.05mol·L-lNaCl、NaI的混合溶液中滴加2滴0.01mol·L-lAgNO3溶液,振荡,沉淀呈黄色 | Ksp(AgCl)<Ksp(AgI) |
D | 室温下,用pH试纸测得0.1mol·L-l NaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
A. A B. B C. C D. D