题目内容
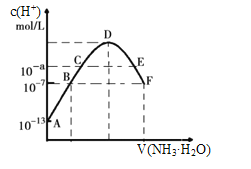
【题目】将一定质量的Mg和Al的混合物投入2.0mol/L,250 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示。则下列说法正确的是( )

A.当加氢氧化钠溶液体积为20mL时,溶液的pH值等于7
B.当加氢氧化钠溶液体积为20mL时,溶液中的溶质只有硫酸镁和硫酸铝
C.NaOH溶液的物质的量浓度为5 mol/L
D.生成的H2在标准状况下的体积为11.2 L
【答案】C
【解析】
根据图象可知,从开始至加入NaOH溶液20mL时没有沉淀生成,说明在反应中硫酸是过量的。加入的氢氧化钠首先中和剩余的硫酸,反应的化学方程式为H2SO4+2NaOH=Na2SO4+2H2O。继续加入氢氧化钠,此时开始出现沉淀,发生的反应为Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓。当沉淀达到最大值时再加入氢氧化钠,此时氢氧化铝开始溶解,反应的方程式为NaOH+Al(OH)3=NaAlO2+2H2O。当沉淀不再减少时,所得沉淀全部为Mg(OH)2,物质的量为0.15mol,则Al(OH)3的物质的量=0.35mol-0.15mol=0.2mol,据以上分析解答。
根据图象可知,从开始至加入NaOH溶液20mL时没有沉淀生成,说明在反应中硫酸是过量的。加入的氢氧化钠首先中和剩余的硫酸,反应的化学方程式为H2SO4+2NaOH=Na2SO4+2H2O。继续加入氢氧化钠,此时开始出现沉淀,发生的反应为Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓。当沉淀达到最大值时再加入氢氧化钠,此时氢氧化铝开始溶解,反应的方程式为NaOH+Al(OH)3=NaAlO2+2H2O。当沉淀不再减少时,所得沉淀全部为Mg(OH)2,物质的量为0.15mol,则Al(OH)3的物质的量=0.35mol-0.15mol=0.2mol,
A、当V(NaOH溶液)=20mL时,溶质有硫酸镁、硫酸铝和硫酸钠,铝离子水解,溶液呈酸性,A错误;
B、根据以上分析可知由图象可知,当加氢氧化钠溶液体积为20mL时,溶液中的溶质有硫酸镁、硫酸铝和硫酸钠,B错误;
C、沉淀量最大时溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(NaOH)=2n(Na2SO4)=2×0.25L×2mol/L=1mol,所以NaOH溶液的物质的量浓度为![]() =5 mol/L,C正确;
=5 mol/L,C正确;
D、根据镁原子和铝原子守恒可知n(Al)=n[Al(OH)3]=0.2mol,n(Mg)=n[Mg(OH)2]=0.15mol。则根据电子转移守恒可知2n(H2)=3n(Al)+2n(Mg)=3×0.2mol+2×0.15mol=0.9mol,因此n(H2)=0.45mol,所以在标准状况下氢气体积为0.45mol×22.4mol/L=10.08L,D错误;
答案选C。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案