题目内容
【题目】在T℃,将amolN2和bmolO2充入体积为IL的密闭容器中发生反应: N2(g)+O2(g)=2NO(g)△H=181.5kJ/mol,反应过程中v正与v逆的变化如图所示。下列说法正确的是

A.若t1时NO为cmol,则0~t1时间段内平均反应速率v(N2)=
B.t1~t2时间段内v正(O2)=2v逆(NO)
C.图中所示的阴影部分面积的含义是v正与v逆的差
D.其他条件不变,t2时刻升高温度,v正与v逆均增大,且v正>v逆
【答案】D
【解析】
A、若t1时NO为c mol,由N2(g)+O2(g)=2NO(g)可知:反应的N2为![]() mol,则0~t1时间段内平均反应速率v(N2)=
mol,则0~t1时间段内平均反应速率v(N2)=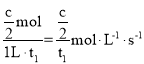 ,故A错误;
,故A错误;
B、速率比与方程式计量数成正比,t1~t2时间段内2v正(O2)=v逆(NO),故B错误;
C、图中所示的阴影部分面积的含义是v正t1与v逆t1的差,即该物质浓度的变化量,故C错误;
D、N2(g)+O2(g) =2NO(g) △H=181.5 kJ/mol是吸热反应,其他条件不变,t2时刻升高温度,v正与v逆均增大,平衡向吸热方向移动,即v正>v逆,故D正确;
故选D。

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目