��Ŀ����
����Ŀ��������������������Ϊ�ҹ�������������ȫ���Ļ�������֮һ��
������β���ǿ�����Ⱦ����Ҫԭ������β������ԭ��Ϊ��
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ��H <0��
2CO2(g)+N2(g) ��H <0��
(1)�÷�Ӧ��ƽ�ⳣ������ʽΪ____________________��
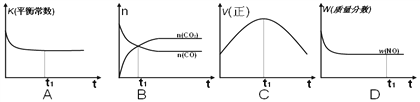
(2)��һ���ݵľ�������(������緢���Ƚ���)��ģ��������Ӧ�������ʾ��ͼ��ȷ����˵����Ӧ��t1ʱ�̴ﵽƽ��״̬����__________��
��úȼ�ղ����������к��д���������������������صĻ�����Ⱦ���⡣
(1) ���������ﶼ���γ����ꡣΪ����������������д�ʩ�в����е���_______(�����)��
a.����ú��ȼ�ϡ� b.�ѹ������̴ѼӸߡ� c.ȼ������
d.ȼúʱ������������ e.��������Դ
(2)úȼ�ղ����ĵ��������������CH4����ԭ����֪��
CH4(g) + 2NO2(g) = N2(g) +CO2(g) + 2H2O(g) ��H =��867kJ/mol
2NO2(g) = N2O4(g) ��H =��56.9kJ/mol
H2O(l) = H2O(g) ��H =+44kJ/mol
д��CH4(g) ��ԭN2O4(g)����N2(g) ��CO2(g)��H2O(l)���Ȼ�ѧ����ʽ________________��
���𰸡� ![]() A��D b��d CH4(g) + N2O4(g) ==N2(g) +CO2(g) + 2H2O(l) ��H =��898.1kJ/mol
A��D b��d CH4(g) + N2O4(g) ==N2(g) +CO2(g) + 2H2O(l) ��H =��898.1kJ/mol
��������I��(1)���ݷ���ʽ��֪�÷�Ӧ��ƽ�ⳣ������ʽΪ K��c2(CO2)��c(N2)/(CO2)��c(N2)/[c2(NO)��c2(CO)]��(2)A���÷�Ӧ�Ƿ��ȷ�Ӧ�������������¶����ߣ�ƽ�ⳣ��K��С��A��ȷ��B��ֻ�е�n(CO)��n(H2)��n(CH3OH)���ٸı�ʱ����˵���ﵽƽ��״̬��B����C����Ӧ�ھ��������н��У���Ӧ��ʼ�ܷ�Ӧ��Ũ�Ƚ��ͣ�����Ϊ��Ӧ�Ƿ��ȷ�Ӧ�������������¶����ߣ���Ӧ���ʼӿ죻��Ӧ�������ŷ�Ӧ��Ũ�ȵĽ��ͣ���Ӧ���ʼ�����v���������ʱ������˵���ﵽƽ��״̬��ֻ�е�v���������ٸı�ʱ������˵���ﵽƽ��״̬��C����D����Ϊ��ʼʱ�������CO��H2�����ŷ�Ӧ����CO������������С�����䲻��ʱ��˵���ﵽƽ��״̬��D��ȷ����ѡAD��
��(1)a.����ú��ȼ�Ͽ��Լ������������a��ȷ��b.�������̴ѼӸ߲��ܼ���SO2�ŷţ�b����c.ȼ��������Լ������������c��ȷ��d.ȼ��ʱ���������������ܼ���SO2�ŷţ�d����e.��������Դ���Լ������������e��ȷ����ѡbd��(2)��֪��
��CH4(g)+2NO(g)=N2(g)+CO2(g)+ 2H2O(g) ��H=-867kJ/mol
��2NO2(g)=N2O4(g) ��H=-56.9kJ/mol
��H2O(l)=H2O(g) ��H=+44kJ/mol
���ݸ�˹���ɿ�֪�٣��ڣ��ۡ�2���õ�CH4(g)��ԭN2O2(g)����N2(g)��CO2(g)��H2O(l)���Ȼ�ѧ����ʽΪCH4(g)��N2O4(g)=N2(g)��CO2(g) ��H=��898.1kJ��mol��1��

 ���ſ����ϵ�д�
���ſ����ϵ�д� ���Ŀ����ϵ�д�
���Ŀ����ϵ�д�����Ŀ��(1)��֪NO2��N2O4�Ľṹʽ����ͼ��ʾ����֪��N��N�ļ���Ϊa kJ/mol��NO2��N2O4��N=O�����ֱܷ���b kJ/mol��c kJ/mol��д��NO2ת��ΪN2O4���Ȼ�ѧ����ʽ________________����H��a��b��c�Ĵ���ʽ��ʾ����

(2)��100��ʱ����0.4mol NO2����2L����������з�����Ӧ��2NO2![]() N2O4�������������������ʵ�����ʱ��仯���±���
N2O4�������������������ʵ�����ʱ��仯���±���
ʱ��/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.4 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
�����������£�ǰ20s����NO2��ʾ��ƽ����ѧ��Ӧ����Ϊ_________________________���ﵽƽ��״̬ʱ��NO2��ת������________��
��n2_______ n3(����>������=������<��)��
��80sʱ���������ڼ���NO2��N2O4��0.24mol����ѧƽ�⽫_________(����������Ӧ�����ƶ������� ���淴Ӧ�����ƶ����������ƶ���)��
������NO2����ʼ���ʵ�����Ϊ0.2mol������ͬ�����½���ʵ�飬Ҫ��ﵽ������ƽ����ͬ��ƽ��״̬������ʼʱ����Ҫ����������N2O4���壬��N2O4��Ũ��Ϊ_____________��



