题目内容
【题目】下列热化学方程式中,正确的是( )
A. 甲烷的燃烧热为 890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol
B. 500℃、30MPa 下,将 0.5mol N2和 1.5molH2置于密闭容器中充分反应生成 NH3(g),放热 19.3 kJ,其热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) △H = -38.6 kJ/mol
2NH3(g) △H = -38.6 kJ/mol
C. 稀盐酸和 稀氢氧化钠溶液混合, 其热化学方程式为:H+(aq)+OH-(aq)=H2O(1) △H = -57.3 kJ/mol
D. 1molH2完全燃烧放热 142.9kJ,则氢气燃烧的热化学方程式为: 2H2(g)+O2(g)=2H2O(1)△H =+285.8 kJ/mol
【答案】C
【解析】
A.甲烷的燃烧热为 890.3 kJ/mol表示1mol甲烷完全燃烧产生二氧化碳气体和液态水时放出的热量,题干水为气态,所以A选项错误;
B.该反应为可逆反应,将 0.5mol N2和 1.5molH2置于密闭容器中不能完全反应转化为1molNH3,热化学方程式中表示的是物质完全转化时的热量变化,B错误;
C.稀盐酸和 稀氢氧化钠反应的实质是H+与OH-结合形成水,反应的热化学方程式为H+(aq)+OH-(aq)=H2O(1) △H = -57.3 kJ/mol,C正确;
D.物质燃烧放出热量,△H<0,D错误;
故合理选项是C。

【题目】工业上用含三价钒(V2O3)为主的某石煤为原料(含有 Al2O3、CaO 等杂质),钙化法焙烧制备 V2O5,其流程如下:
![]()
(资料)+5 价钒在溶液中的主要存在形式与溶液 pH 的关系:
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要离子 | VO2+ | VO3- | V2O74- | VO43- |
(1)焙烧: 向石煤中加生石灰焙烧,将 V2O3 转化为 Ca(VO3)2 的化学方程式是______________。
(2)酸浸:①Ca(VO3)2 难溶于水,可溶于盐酸。若焙砂酸浸时溶液的 pH=4,Ca(VO3)2 溶于盐酸的离子方程式是________。
②酸度对钒和铝的溶解量的影响如图所示:酸浸时溶液的酸度控制在大约 3.2%,根据下图推测,酸浸时不选择更高酸度的原因是________________。
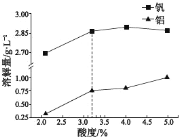
(3)转沉: 将浸出液中的钒转化为 NH4VO3 固体,其流程如下:
![]()
①浸出液中加入石灰乳的作用是_____。
②向(NH4)3VO4 溶液中加入 NH4Cl 溶液,控制溶液的 pH=7.5。当 pH>8 时,NH4VO3 的产量明显降低,原因是_______________。
(4)测定产品中 V2O5 的纯度:称取 ag 产品,先用硫酸溶解,得到(VO2)2SO4 溶液。再加入 b1mLc1mol/L(NH4)2Fe(SO4)2 溶液(VO2++2H++Fe2+=VO2++Fe3++H2O) 最后用 c2mol/LKMnO4 溶液滴定过量的(NH4)2Fe(SO4)2 至终点,消耗 KMnO4 溶液的体积为 b2mL。已知 MnO4-被还原为 Mn2+,假设杂质不参与反应。则产品中 V2O5 的质量分数是_____。(V2O5 的摩尔质量::182g/mol)