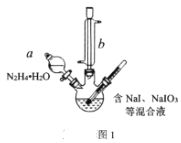
题目内容
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24L三氯甲烷中含氢原子数为0.1 NA
B.0.1mo1L-1 Na2SO3溶液中,含硫元素的粒子数目之和为0.1NA
C.8.0gNH4NO3发生反应5NH4NO3= 4N2+2HNO3+9H2O,转移电子数为0.3 NA
D.0.1mo1P35Cl3与足量37Cl2发生反应:PCl3+Cl2![]() PCl5,产物中P—37Cl键数为0.2 NA
PCl5,产物中P—37Cl键数为0.2 NA
【答案】C
【解析】
A.标准状况下,三氯甲烷呈液态,无法计算含氢原子数,A不正确;
B.没有告诉0.1mo1L-1 Na2SO3溶液的体积,无法计算含硫元素的粒子数目,B不正确;
C.8.0gNH4NO3为0.1mol,发生反应5NH4NO3= 4N2+2HNO3+9H2O,转移电子数为0.1mol ×![]() ×NA=0.3 NA,C正确;
×NA=0.3 NA,C正确;
D.0.1mo1P35Cl3与足量37Cl2发生反应:PCl3+Cl2![]() PCl5,因为反应可逆,所以产物中P—37Cl键数小于0.2 NA,D不正确;
PCl5,因为反应可逆,所以产物中P—37Cl键数小于0.2 NA,D不正确;
故选C。

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目