题目内容
【题目】某小组探究从印刷电路板回收液(pH=1,含Fe2+、Cu2+、Cl-及少量Fe3+)制取磁性氧化铁,并测定其中Fe3+和Fe2+的物质的量比,过程如下:
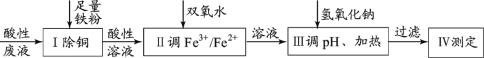
已知: 25℃时:Ksp[Fe(OH)2]=8.0×10–16;溶解度S( FeCl2 )=64g。
(1)过程Ⅰ中除铜反应的离子方程式为_______。
(2)过程Ⅱ用H2O2调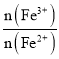 比为1.6:1。该过程中有少量无色气体生成,主要原因是______。
比为1.6:1。该过程中有少量无色气体生成,主要原因是______。
(3)过程Ⅲ:调pH、加热
(i)甲同学将溶液迅速调至pH≈4,产生沉淀,通过下列①和②推断沉淀的成分。
①取静置后的上层清液,___________,证明清液中含Fe2+;
②甲同学通过已知条件计算,推断沉淀中一定不含Fe(OH)2,其推断过程是______。
(ii)乙同学探究不同反应条件对产品质量的影响
①若调节pH过程太慢,在pH≈5时,Fe2+容易在空气中发生副反应,生成FeO(OH)固体影响产品质量。写出该反应的离子方程式________。
②若其它条件不变,调节pH过高( pH >9 )、温度高于95oC,产品会掺杂较多红棕色杂质,试分析可能的原因__________。
(iii)丙同学迅速将溶液调节pH=9,在80~90℃下搅拌2小时。过滤、洗涤、干燥得到晶体产品。写出制得晶体产品的离子方程式________。
(4)Ⅳ测定
取产品样品ag,加过量硫酸溶解,得到样品溶液。用c mol/L KMnO4标准液滴定。(已知:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与KMnO4反应,且数据为多次测量平均值)。
i. 取v0 mL样品溶液,用标准液滴定至终点,消耗标准液v1 mL。
ii.另取v0 mL样品溶液,加入适量锌粉充分反应(将Fe3+完全转化为Fe2+),过滤,再用标准液滴定滤液至终点,消耗标准液v2 mL。
(5)晶体中Fe3+和Fe2+的物质的量比是_________(用含v1、v2的计算式表示)。
【答案】Fe+Cu2+=Fe2++Cu Fe3+催化,使H2O2分解放出氧气 加入铁氰化钾溶液,出现蓝色沉淀 Ksp[Fe(OH)2]=8.0×10–16,pH=4时,生成Fe(OH)2沉淀所需c(Fe2+)>8×104 mol/L,根据氯化亚铁溶解度,溶液中亚铁离子浓度不可能达到 4Fe2++O2+6H2O=4FeO(OH) +8H+ pH过高(pH>9)、温度高于95oC,Fe(OH)2还原性增强,与空气中氧气反应速率加快,使Fe(OH)3增加过多,Fe(OH)3分解成红棕色Fe2O3 Fe2++2Fe3++8OH-![]() Fe3O4↓+4H2O
Fe3O4↓+4H2O ![]()
【解析】
印刷电路板回收液的pH=1,含Fe2+、Cu2+、Cl-及H+和少量Fe3+,由于微粒的氧化性:Fe3+>Cu2+>H+>Fe2+,向其中加入足量的Fe粉,会先后发生反应:2Fe3++Fe=3Fe2+;Fe+Cu2+=Fe2++Cu;Fe+2H+=Fe2++H2↑.然后过滤除去过量的Fe及产生的Cu,向滤液中加入双氧水,发生反应:2Fe2++H2O2+2H+=2Fe3++2H2O,调整溶液中Fe3+与Fe2+的物质的量的比,使n(Fe3+):n(Fe2+)=1.6:1,然后向溶液中加入NaOH溶液,调整溶液pH,发生反应产生Fe3O4和H2O,过滤得到磁性氧化铁。
(1)过程Ⅰ中Fe与Cu2+发生置换反应产生Cu单质与Fe2+,所以过程Ⅰ中除铜反应的离子方程式为Fe+Cu2+=Fe2++Cu;
(2)过程Ⅱ中加入H2O2,发生氧化还原反应:2Fe2++H2O2+2H+=2Fe3++2H2O,调n(Fe3+):n(Fe2+)比为1.6:1,在此过程中有少量无色气体生成,该气体为O2,这是由于Fe3+具有催化作用,能够使H2O2分解放出O2;
(3)(i)①取静置后的上层清液,向其中加入K3[Fe(CN)6]溶液,若产生蓝色沉淀,就证明该溶液中含有Fe2+;
②pH≈4时,c(H+)=10-4 mol/L,则溶液中c(OH-)=![]() mol/L=10-10 mol/L,由于在25℃时:Ksp[Fe(OH)2]=8.0×10–16,则要形成Fe(OH)2沉淀,需要Fe2+的最小浓度为c(Fe2+)>
mol/L=10-10 mol/L,由于在25℃时:Ksp[Fe(OH)2]=8.0×10–16,则要形成Fe(OH)2沉淀,需要Fe2+的最小浓度为c(Fe2+)>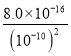 =8.0×104 mol/L,根据氯化亚铁溶解度,S(FeCl2)=64g,则溶液中亚铁离子浓度不可能达到,因此沉淀中一定不含有Fe(OH)2;
=8.0×104 mol/L,根据氯化亚铁溶解度,S(FeCl2)=64g,则溶液中亚铁离子浓度不可能达到,因此沉淀中一定不含有Fe(OH)2;
(ii)①若调节pH过程太慢,在溶液pH≈5时,Fe2+容易被溶解在溶液中的O2氧化生成FeO(OH)固体影响产品质量,发生反应的离子方程式为:4Fe2++O2+6H2O=4FeO(OH) +8H+;
②若其它条件不变,调节pH过高,如溶液pH>9、温度高于95oC,Fe(OH)2还原性增强,与空气中氧气反应速率加快,使Fe(OH)3增加过多,Fe(OH)3受热分解产生红棕色Fe2O3,使产品中混有较多红棕色杂质;
(iii)迅速将溶液调节pH=9,在80~90℃下搅拌2小时,发生反应:Fe2++2Fe3++8OH-![]() Fe3O4↓+4H2O,然后过滤、洗涤、干燥得到晶体产品;
Fe3O4↓+4H2O,然后过滤、洗涤、干燥得到晶体产品;
(4)取产品样品a g,加过量硫酸溶解,发生反应:Fe3O4+8H+=Fe2++2Fe3++4H2O,得到样品溶液,然后用col/LKMnO4标准液滴定,发生MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O。
i.取v0mL样品溶液,用标准液滴定至终点,消耗标准液v1mL,n(KMnO4)=c·V=c mol/L×v1×10-3 L=cv1×10-3 mol;则n(Fe2+)=5n(KMnO4)=5cv1×10-3 mol;
ii.另取v0mL样品溶液,加入适量锌粉充分反应(将Fe3+完全转化为Fe2+),过滤,再用标准液滴定滤液至终点,消耗标准液v2mL,则反应后溶液中Fe2+总物质的量为n(Fe2+)=5n(KMnO4)总=5cv2×10-3 mol;原溶液中Fe3+的物质的量为n(Fe3+)=5cv2×10-3 mol-5cv1×10-3 mol=5c(v2-v1)×10-3 mol。
(5)晶体中Fe3+和Fe2+的物质的量比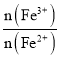 =
=![]() =
=![]() 。
。