题目内容
13.与氖的核外电子排布相同的离子跟与氩核外电子排布相同的离子所形成的化合物是( )| A. | MgBr2 | B. | Na2S | C. | KI | D. | KCl |
分析 与氖原子核外电子排布相同的离子有:N3-、O2-、F-、Na+、Mg2+、Al3+,跟氩原子核外电子排布相同的离子有P3-、S2-、Cl-、K+、Ca2+,据此分析解答.
解答 解:与氖原子核外电子排布相同的离子有:N3-、O2-、F-、Na+、Mg2+、Al3+,跟氩原子核外电子排布相同的离子有P3-、S2-、Cl-、K+、Ca2+,
A.Mg2+和Ne核外电子排布式相同、Br-和Ar原子核外电子排布式不相同,所以不符合条件,故A错误;
B.Na+与Ne原子核外电子排布式相同,S2-和Ar原子核外电子排布式相同,所以符合条件,故B正确;
C.Na+与Ne原子核外电子排布式相同,I-和Ar原子核外电子排布式不相同,所以不符合条件,故C错误;
D.Cl-、K+和Ar原子核外电子排布式相同,不符合条件,故D错误;
故选B.
点评 本题考查了离子核外电子排布式,明确形成10电子、18电子简单离子有哪些是解本题关键,根据离子是否符合题意即可,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.红矾钠(重铬酸钠:Na2Cr2O7•2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛.
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO•Cr2O3)利用以下过程来制取.
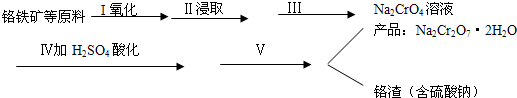
①步骤I中反应的化学方程式为:
4FeO•Cr2O3(s)+8Na2CO3(s)+7O2=8Na2Cro4(s)+2Fe2O3+8CO2该反应的化学平衡常数的表达式为K=$\frac{c(C{O}_{2})^{8}}{c({O}_{2})^{7}}$,在常温下该反应速度极慢,下列措施中能使反应速率增大的是ABC.
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是NaA1O2[或NaA1(OH)4]、Na2SiO3.
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是除去A1O-2、SiO32-等杂质.
④步骤Ⅳ中发生反应的离子方程式为:2CrO42-+2H+=Cr2O72-+H2O.
(2)将红矾钠与KCl固体按1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体.请填写表中空格,完成上述过程.(已知:在室温下重铬酸钾溶解度很小,而在升高温度时,其溶解度大大增加).
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO•Cr2O3)利用以下过程来制取.

①步骤I中反应的化学方程式为:
4FeO•Cr2O3(s)+8Na2CO3(s)+7O2=8Na2Cro4(s)+2Fe2O3+8CO2该反应的化学平衡常数的表达式为K=$\frac{c(C{O}_{2})^{8}}{c({O}_{2})^{7}}$,在常温下该反应速度极慢,下列措施中能使反应速率增大的是ABC.
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是NaA1O2[或NaA1(OH)4]、Na2SiO3.
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是除去A1O-2、SiO32-等杂质.
④步骤Ⅳ中发生反应的离子方程式为:2CrO42-+2H+=Cr2O72-+H2O.
(2)将红矾钠与KCl固体按1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体.请填写表中空格,完成上述过程.(已知:在室温下重铬酸钾溶解度很小,而在升高温度时,其溶解度大大增加).
| 序号 | 实验步骤 | 简述实验操作(不必叙述如何组装实验装置) |
| ① | 溶解 | 将混合物放入烧杯中,加入热的蒸馏水,充分搅拌直到固体不再溶解. |
| ② | ||
| ③ | ||
| ④ | ||
| ⑤ | 过滤、干燥 | 得到K2Cr2O7晶体 |
1.配制100mL浓度为2mol/L NaOH溶液过程中,下列部分实验操作正确的是( )
| A. | 称取8g NaOH固体放入烧杯中,加入100 mL蒸馏水,并不断搅拌至固体溶解 | |
| B. | 称取8g NaOH固体,放入100 mL容量瓶中,加入蒸馏水使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 | |
| C. | 称取8 g NaOH固体,放入100 mL量筒中,加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL | |
| D. | 称取8g NaOH固体放入烧杯中,加入适量蒸馏水溶解,冷却后将烧杯中溶液注入100 mL容量瓶后,用少量蒸馏水洗涤烧杯内壁2~3次 |
18.下列关于碱金属的叙述中不正确的是( )
| A. | 碱金属单质在化学反应中表现出强还原性 | |
| B. | Li 在氧气中燃烧主要生成Li2O2 | |
| C. | 碱金属离子的氧化性随着离子半径的增大而减小 | |
| D. | 随核电荷数的增加,单质与水反应剧烈程度增大 |
5.X、Y和Z是短周期元素组成的三种单质,X的组成元素是第三周期原子半径最大的元素;Y和Z均由元素R组成,Y由两个原子组成,R最外层电子数是内层电子数的3倍,下列推断正确的是( )
| A. | Y和Z互为同位素 | |
| B. | X和Y能化合成两种化合物 | |
| C. | X和Y化合的产物中一定不含有共价键 | |
| D. | X离子比R的离子半径大 |
2.符号为N的能层最多能容纳的电子数是( )
| A. | 18 | B. | 32 | C. | 14 | D. | 15 |


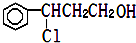 $\stackrel{②}{→}$X$→_{③△}^{NaOH乙醇溶液}$乙
$\stackrel{②}{→}$X$→_{③△}^{NaOH乙醇溶液}$乙 .
.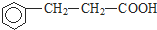 ).写出同时符合下列要求的丙的同分异构体结构简式
).写出同时符合下列要求的丙的同分异构体结构简式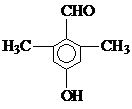 、
、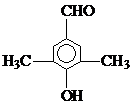 .
.