题目内容
17.某化学反应过程如图所示,由图得出的判断,正确的是( )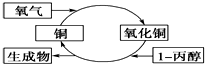
| A. | 生成物是丙酮 | |
| B. | 1-丙醇发生了还原反应 | |
| C. | 反应中有红黑颜色交替变化的现象发生 | |
| D. | 醇类都能发生图示的催化氧化反应 |
分析 Cu与氧气反应生成CuO,1-丙醇与氧化铜发生反应:CH3CH2CH2OH+CuO$\stackrel{△}{→}$CH3CH2CHO+Cu+H2O,1-丙醇发生氧化反应,羟基连接的碳原子上没有H原子的醇不能图中发生催化氧化反应.
解答 解:A.1-丙醇与氧化铜发生反应:CH3CH2CH2OH+CuO$\stackrel{△}{→}$CH3CH2CHO+Cu+H2O,图中生成为丙醛,故A错误;
B.反应中1-丙醇发生氧化反应生成丙醛,故B错误;
C.Cu与氧气反应生成CuO,红色金属变为黑色,1-丙醇与氧化铜发生反应CH3CH2CH2OH+CuO$\stackrel{△}{→}$CH3CH2CHO+Cu+H2O,有红色金属生成,反应中有红黑颜色交替变化的现象发生,故C正确;
D.羟基连接的碳原子上有H原子的醇可以图中发生催化氧化反应,而羟基连接的碳原子上没有H原子的醇不能图中发生催化氧化反应,故D错误,
故选:C.
点评 本题考查醇的催化氧化,比较基础,注意理解醇发生催化氧化反应原理.

练习册系列答案
相关题目
5.X、Y和Z是短周期元素组成的三种单质,X的组成元素是第三周期原子半径最大的元素;Y和Z均由元素R组成,Y由两个原子组成,R最外层电子数是内层电子数的3倍,下列推断正确的是( )
| A. | Y和Z互为同位素 | |
| B. | X和Y能化合成两种化合物 | |
| C. | X和Y化合的产物中一定不含有共价键 | |
| D. | X离子比R的离子半径大 |
12.将甲苯(C7H8)和甘油(C3H8O3)以一定比例混合,测得混合物含碳51.3%,则氧的质量分数为( )
| A. | 40% | B. | 35% | C. | 30% | D. | 无法计算 |
2.符号为N的能层最多能容纳的电子数是( )
| A. | 18 | B. | 32 | C. | 14 | D. | 15 |
7.某元素最高价氧化物对应水化物的化学式是H2RO4,这种元素的气态氢化物的化学式为( )
| A. | HR | B. | H2R | C. | RH3 | D. | RH4 |
 某化学兴趣小组设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质
某化学兴趣小组设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质