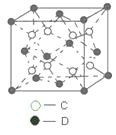
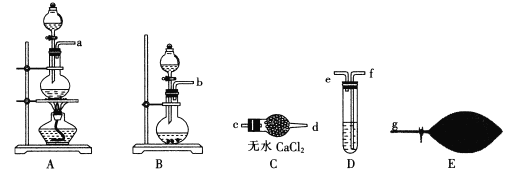
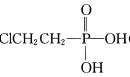
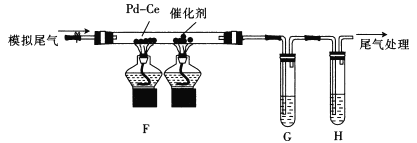
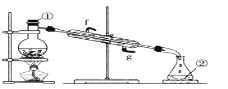
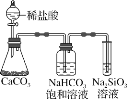
��Ŀ����
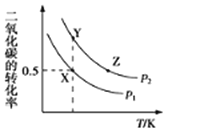
����Ŀ���������δ������£�����������Ϊԭ�ϣ�˫��ˮΪ�������ɺϳɻ��������ᡣ��������ת���ʺͻ���������ѡ�������¶Ⱥʹ��������ı仯��ͼ��ʾ(��������������ͬ)������˵������ȷ����( )
![]()
![]()
![]()
![]()
![]()
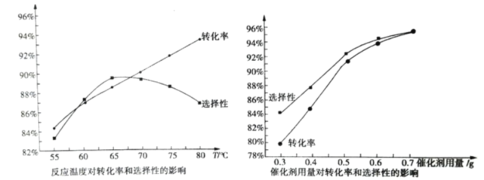
A.�����������ѡ������������������Ӷ����ӣ��ʴ�������Խ��Խ��
B.���¶ȵ��� 65��ʱ�������������ѡ�������¶����߶�����
C.���ߵ�һ���¶Ⱥ����������ѡ���Խ��ͣ�ԭ������ǻ��������ᷢ����ˮ�ⷴӦ
D.��ʵ�����˵ķ�Ӧ�¶�Ϊ 65��
���𰸡�A
��������
A��ͼ��仯��������ѡ���Դﵽһ���̶�ʱ�����Ӵ��������������������ѡ�������Ӳ����ǵ��ɱ��;���Ч�棬����һζ�Ӵ��������������A����
B��ͼ�������֪���¶ȵ��� 65��ʱ�������������ѡ�������¶����߶�����B��ȷ��
C���¶����ߴٽ�ˮ�⣬���»��������ᷢ���˸���Ӧˮ�ⷴӦ�����´���ѡ�����½�����C��ȷ��
D���¶ȸ���65��ʱ����������ֽ⣬���������ᷢ����ˮ�ⷴӦ���������ڷ�Ӧ���У���D��ȷ��
��ѡA��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��
��.�����£�����c(H+) ��ͬ�Ĵ���������ң�
(1)��ͬ�����£�ȡ������ļ�������Һ����ϡ��100����ϡ�ͺ����Һ����c(H+) ��С��ϵΪ��
�� _____________�� (������������С������������������ͬ)��
(2)��ȡ25 mL�ļ�������Һ���ֱ����Ũ�ȵ�NaOHϡ��Һ��ȫ��Ӧ�������ĵ�NaOH��Һ�������С��ϵΪV(��) _____________ V(��)��
��.��֪25 ��ʱ�й�����ĵ���ƽ�ⳣ�����£�
���ữѧʽ | HSCN | CH3COOH | HCN | H2CO3 |
����ƽ�ⳣ�� | 1.3��10-1 | 1.8��10-5 | 4.9��10-10 | Ka1=4.3��10-7 Ka2=5.6��10-11 |
(1)25 ��ʱ����20 mL 0.1 mol��L-1 CH3COOH��Һ��20 mL 0.1 mol��L-1 HSCN��Һ�ֱ���20 mL 0.1 mol��L-1 NaHCO3��Һ��ϣ�ʵ���ò������������(V)��ʱ��(t)�ı仯��ͼ��ʾ��
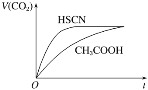
��Ӧ��ʼ��������Һ����CO2��������ʴ������Բ����ԭ���� _____________��
(2)�������¶Ȳ��䣬�ڴ�����Һ��ͨ��һ�������������и������С���� ______________(����ĸ)��
a.c(CH3COO-) b.c(H+) c.Kw d.�������ƽ�ⳣ��
III.(1)HClO4H2SO4HCl��HNO3����ǿ�ᣬ��������ˮ��Һ�в��������ij�¶������������ڱ������еĵ��볣��������˵������ȷ���� _________��
�� | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6��10-5 | Ka1��6.3��10-9 | 1.6��10-9 | 4.2��10-10 |
A.�¶Ȼ�Ӱ�����������ڱ����еĵ��볣��
B.�ڱ�������HClO4��������������ǿ����
C.�ڱ�������H2SO4�ĵ��뷽��ʽΪH2SO4===2H++SO42-
D.���������ڱ������ж�û����ȫ���룬��������ǿ�����
(2)�������Ƕ�Ԫ��ǿ�ᣬ25 ��ʱ������(H3PO3)�ĵ��볣��ΪK1=1��10-2K2=2.6��10-7��
���Դӵ���ƽ���ƶ��ĽǶȽ���K1Ϊʲô��K2��_______________________ ��
��д��������ĵ��뷽��ʽ(2��)_________________��_______________ ��
�������һ�ַ�����ʹ֮��ͨ��ֱ�۵�ʵ�������жϴ��������ǿ��H2S���÷������õ��Լ��� __________����Ӧ�Ļ�ѧ����ʽΪ _____________________��