题目内容
7.为验证卤素单质氧化性的相对强弱,某小组用下图装置进行实验 (夹持仪器略去,气密性已检查).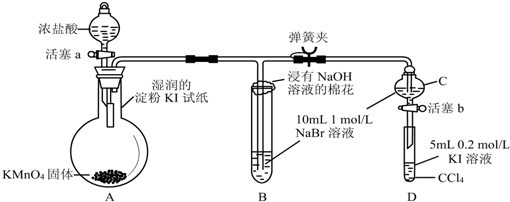
实验过程:Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸.
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹.
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a.
Ⅳ.打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡.静止后CCl4层溶液变为紫红色.
(1)装浓盐酸的仪器名称是分液漏斗.
(2)B中溶液发生反应的离子方程式是Cl2+2Br-═Br2+2Cl-.
(3)过程Ⅲ实验的目的是确保C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰.
(4)验证氯气的氧化性强于碘的实验现象是湿润的淀粉KI试纸变蓝.
(5)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下电子层数依次增多,原子半径逐渐增大,得电子能力逐渐减弱.
分析 (1)依据装置图和反应原理分析仪器的名称;
(2)氯气的氧化性强于溴,将氯气通入NaBr溶液中会有单质溴生成和氯化钠,从而写出离子方程式;
(3)为验证溴的氧化性强于碘,实验时应避免氯气的干扰;
(4)氯气氧化性强于单质碘,碘遇淀粉变蓝色;
(5)从原子结构(电子层数、原子半径)的角度分析.
解答 解:(1)装置是利用二氧化锰和浓盐酸加热反应制备氯气的装置图,A为分液漏斗是加入浓盐酸的仪器,故答案为:分液漏斗;
(2)氯气的氧化性强于溴,将氯气通入NaBr溶液中会有单质溴生成和氯化钠,发生反应的离子方程式为:Cl2+2Br-═Br2+2Cl-;
故答案为:Cl2+2Br-═Br2+2Cl-;
(3)为验证溴的氧化性强于碘,实验时应避免氯气的干扰,当B中溶液由黄色变为棕红色时,说明有大量的溴生成,此时应关闭活塞a,否则氯气过量,影响实验结论;
故答案为:确保C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰;
(4)淀粉变蓝色,说明有单质碘生成,同时也说明氯气氧化性强于单质碘,故答案为:湿润的淀粉KI试纸变蓝;
(5)因同一主族元素,从上到下,电子层数依次增多,原子半径逐渐增大,元素的金属性逐渐增强,得电子能力逐渐减弱,故答案为:电子层数依次增多,原子半径逐渐增大.
点评 本题考查了卤素单质的性质及检验方法,题目难度中等,注意掌握卤素单质的性质及递变规律,试题侧重基础知识的考查,培养了学生灵活应用基础知识的能力和化学实验能力.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
18.下列说法正确的是( )
| A. | 碳水化合物都符合通式Cn(H2O)m | |
| B. | 符合通式Cn(H2O)m的物质都是糖类 | |
| C. | 糖类物质都有甜味 | |
| D. | 糖类是人类维持生命的六大营养素之一 |
2.如图表示的是向MgCl2、AlCl3的混合溶液中开始时滴加试剂A,之后改滴试剂B,所得沉淀y(mol)与加入试剂体积V(mL)之间的关系.以下结论不正确的是( )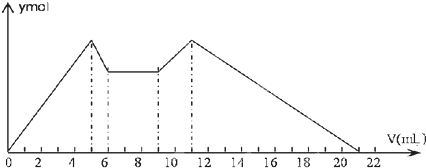

| A. | A是盐酸,B是NaOH溶液,且c(B)=2c(A) | |
| B. | 原混合液中c(Al3+):c(Mg2+):c(Cl-)=1:1:5 | |
| C. | A是NaOH溶液,B是盐酸,且c(NaOH):c(HCl)=2:1 | |
| D. | 从7到9,反应的离子方程式:H++OH-═H2O |
19.不能说明氯元素的非金属性比硫元素强的事实是( )
| A. | Cl2与H2S溶液发生置换反应 | B. | 受热时H2S能分解,HCl则不能 | ||
| C. | 单质硫可在空气中燃烧,Cl2不能 | D. | 溶于水时HCl是强酸,H2S是弱酸 |
17.下列说法或表示方法正确的是( )
| A. | 等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由C(s,石墨)=C(s,金刚石)△H=+119 kJ•mol-1可知,石墨比金刚石稳定 | |
| C. | 在稀溶液中:H++OH-═H2O△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| D. | 在101 kPa时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ•mol-1 |
 (一)石油分馏可以得到汽油.汽油是低沸点的烷烃的混合物,其分子中的碳原子数一般在C5~C12范围内,如戊烷,其分子式为C5H12,石油分馏属于物理变化(填“化学”或“物理”).
(一)石油分馏可以得到汽油.汽油是低沸点的烷烃的混合物,其分子中的碳原子数一般在C5~C12范围内,如戊烷,其分子式为C5H12,石油分馏属于物理变化(填“化学”或“物理”).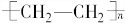 .
.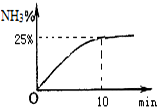 目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合.
目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合.