题目内容
9.下列离子反应方程式正确的是( )| A. | 澄清石灰水来吸收氯气:Cl2+OH-═Cl-+ClO-+H+ | |
| B. | NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 向稀硝酸中加入少量铁粉:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| D. | 在碳酸氢钙溶液中加入少量苛性钾溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
分析 A.澄清石灰水和氯气反应生成氯化钙、次氯酸钙和水;
B.NaHSO4溶液与Ba(OH)2溶液反应至中性,反应物的物质的量之比为2:1;
C.向稀硝酸中加入少量铁粉生成硝酸铁、NO和水;
D.碳酸氢钙溶液中加入少量苛性钾溶液生成碳酸钙和水.
解答 解:A.澄清石灰水和氯气反应生成氯化钙、次氯酸钙和水,反应的离子方程式为澄清石灰水来吸收氯气:Cl2+2OH-═Cl-+ClO-+H2O,故A错误;
B.NaHSO4溶液与Ba(OH)2溶液反应至中性,反应物的物质的量之比为2:1,反应的离子方程式为2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故B正确;
C.向稀硝酸中加入少量铁粉生成硝酸铁、NO和水,反应的离子方程式为Fe+4H++NO3-═Fe3++NO↑+2H2O,故C错误;
D.碳酸氢钙溶液中加入少量苛性钾溶液生成碳酸钙和水,反应的离子方程式为Ca2++HCO3-+OH-═CaCO3↓+H2O,故D错误.
故选B.
点评 本题考查离子方程式的书写,明确物质的性质及离子方程式书写规则是解本题关键,单质、氧化物、气体、沉淀、弱电解质、络合物等写化学式,要遵循电荷守恒、原子守恒及转移电子守恒,离子方程式表示一类反应、化学方程式表示一种反应.

练习册系列答案
相关题目
19.不能说明氯元素的非金属性比硫元素强的事实是( )
| A. | Cl2与H2S溶液发生置换反应 | B. | 受热时H2S能分解,HCl则不能 | ||
| C. | 单质硫可在空气中燃烧,Cl2不能 | D. | 溶于水时HCl是强酸,H2S是弱酸 |
17.下列说法或表示方法正确的是( )
| A. | 等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由C(s,石墨)=C(s,金刚石)△H=+119 kJ•mol-1可知,石墨比金刚石稳定 | |
| C. | 在稀溶液中:H++OH-═H2O△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| D. | 在101 kPa时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ•mol-1 |
4.温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经一段时间后达到平衡.反应过程中测定的部分数据见下表:
下列说法正确的是( )
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50 s的平均速率为v(PCl3)=0.0032mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20mol Cl2,达到平衡前v(正)>v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0 mol PCl3、2.0 mol Cl2,达到平衡时,PCl3的转化率小于80% |
14.如图所示的反应过程中,关于乙烯所发生的反应类型的叙述正确的是( )
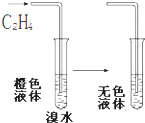

| A. | 氧化反应 | B. | 还原反应 | C. | 取代反应 | D. | 加成反应 |
1.将下列各种液体:①苯;②四氯化碳;③碘化钾溶液;④乙烯;⑤植物油,分别与溴水混合后充分振荡、静置,液体分为两层,原溴水层几乎是无色的是( )
| A. | ②⑤ | B. | 只有②④ | C. | ①②④⑤ | D. | ①②③④⑤ |
18.下列说法正确的是( )
| A. | 甲烷的燃烧热为 890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol | |
| B. | 500℃、30 MPa 下,将 0.5 mol N2 和 1.5 mol H2 置于密闭的容器中充分反应生成 NH3(g),放热 19.3 kJ,其热化学方程式为 N2(g)+3H2(g)?2NH2(g)△H=-38.6 kJ•mol | |
| C. | 一定条件下,反应 N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol降低温度将向正反应方向移动 | |
| D. | 已知 2C(s)+2O2(g)═2CO2(g)△H12C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |