题目内容
14.下列离子反应方程式,书写正确的是( )| A. | 向碳酸钠溶液中加过量盐酸 CO32-+2H+=H2O+CO2↑ | |
| B. | 向稀硫酸溶液中投入铁粉 2Fe+6H+=2Fe3++3H2↑ | |
| C. | 向盐酸中投入碳酸钙 CO32-+2H+=H2O+CO2↑ | |
| D. | .氢氧化钡溶液中加入硫酸 H++OH-=H2O |
分析 A.反应生成氯化钠、水、二氧化碳;
B.反应生成硫酸亚铁、氢气;
C.碳酸钙在离子反应中保留化学式;
D.漏写生成硫酸钡的离子反应.
解答 解:A.向碳酸钠溶液中加过量盐酸的离子反应为CO32-+2H+=H2O+CO2↑,故A正确;
B.向稀硫酸溶液中投入铁粉的离子反应为Fe+2H+=Fe2++H2↑,故B错误;
C.向盐酸中投入碳酸钙的离子反应为CaCO3+2H+=H2O+CO2↑+Ca2+,故C错误;
D.氢氧化钡溶液中加入硫酸的离子反应为SO42-+Ba2++2H++2OH-=2H2O+BaSO4↓,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
10.下列有关叙述正确的是( )
| A. | 只含有离子键的化合物才是离子化合物 | |
| B. | 硫酸铵晶体是含有离子键、极性键和配位键的分子晶体 | |
| C. | 由于I-I键的键能比F-F、Cl-Cl、Br-Br键的键能都小,所以在卤素单质中碘的熔点最低 | |
| D. | 在分子晶体中一定不存在离子键,而在离子晶体中可能存在共价键 |
5.工业上以锂辉石(Li2O•A12O3•4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂.其部分工艺流程如下:

已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250℃~300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
②某些物质的溶解度(S)如下表所示.ⅠⅡⅢ
(1)从滤渣1中分离出Al2O3的部分流程图所示,括号表示加入的试剂,方框表示所得到的物质.则步骤Ⅱ中最佳反应的离子方程式是Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
滤渣1$→_{Ⅰ}^{()}$□$→_{Ⅱ}^{()}$□$→_{Ⅲ}^{灼烧}$Al2O3
(2)已知滤液1中的主要离子为Li+、Mg2+、Ca2+、SO42-,滤渣2的主要成分有Mg(OH)2和CaCO3.向滤液1中加入石灰乳的作用是(运用化学平衡原理简述,并写离子方程式)增加Ca2+、OH-的浓度,有利于Mg(OH)2、CaCO3的析出;Mg2++Ca(OH)2=Mg(OH)2+Ca2+.
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失.
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下.
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3.
①a中,阳极的电极反应式是2C1--2e-=Cl2↑.
②b中,生成Li2CO3反应的化学方程式是2LiOH+NH4HCO3=Li2CO3+NH3•H2O+H2O.

已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250℃~300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
②某些物质的溶解度(S)如下表所示.ⅠⅡⅢ
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
滤渣1$→_{Ⅰ}^{()}$□$→_{Ⅱ}^{()}$□$→_{Ⅲ}^{灼烧}$Al2O3
(2)已知滤液1中的主要离子为Li+、Mg2+、Ca2+、SO42-,滤渣2的主要成分有Mg(OH)2和CaCO3.向滤液1中加入石灰乳的作用是(运用化学平衡原理简述,并写离子方程式)增加Ca2+、OH-的浓度,有利于Mg(OH)2、CaCO3的析出;Mg2++Ca(OH)2=Mg(OH)2+Ca2+.
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失.
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下.
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3.
①a中,阳极的电极反应式是2C1--2e-=Cl2↑.
②b中,生成Li2CO3反应的化学方程式是2LiOH+NH4HCO3=Li2CO3+NH3•H2O+H2O.
2.下列物质熔沸点高低的比较,正确的是( )
| A. | HF>HI | B. | CCl4<CF4 | C. | SiO2<CO2 | D. | NaCl<KCl |
9.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1mol甲醇中含有C-H键的数目为4NA | |
| B. | 标准状况下,22.4L CCl4含有个NA个CCl4分子 | |
| C. | 2.3g甲苯和丙三醇(C3H8O3)的混合物中,含氢原子数目为0.2NA | |
| D. | 标准状况下,2.24 L溴乙烷中含共价键数目为0.7NA |
19.下列说法正确的是( )
| A. | 分子晶体中一定存在分子间作用力 | |
| B. | 分子中含有两个氢原子的酸一定是二元酸 | |
| C. | 含有金属阳离子的晶体一定是离子晶体 | |
| D. | 元素的金属性越强,失去的电子数就越多 |
6.现有化合物:
甲: 乙:
乙: 丙:
丙:
(1)请判别上述哪些化合物互为同分异构体(填编号):甲乙丙.
(2)请分别写出鉴别甲、乙、丙化合物的方法.(指明所选试剂及主要现象即可)
甲:
 乙:
乙: 丙:
丙:
(1)请判别上述哪些化合物互为同分异构体(填编号):甲乙丙.
(2)请分别写出鉴别甲、乙、丙化合物的方法.(指明所选试剂及主要现象即可)
| 试剂 | 现象 | |
| 甲 | 浓溴水或FeCl3溶液 | 白色沉淀或溶液变紫色 |
| 乙 | 碳酸氢钠溶液 | 气体生成 |
| 丙 | 银氨溶液或Cu(OH)2 | 银镜或砖红色沉淀 |
3.下列物质在一定条件下,不能和H2发生加成反应的是( )
| A. | CH3CH2CHO | B. | 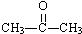 | C. | CH2=CHCOOH | D. | CH3COOCH3 |
