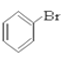
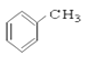
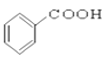
题目内容
【题目】1,4-环己二醇可通过下列路线合成:
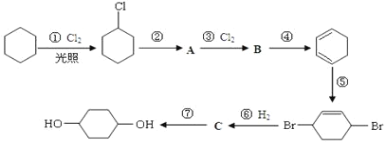
(1)写出反应①、④、⑦的化学方程式:①____________;④____________;⑦____________。
(2)②的反应类型是____________,上述七个反应中属于加成反应的有(填序号)____________。
(3)反应⑤中可能产生一定量的副产物,其可能的结构简式为____________。
【答案】C6H12+Cl2→C6H11Cl+HCl ![]() +2NaOH
+2NaOH 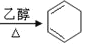 +2NaCl+2H2O
+2NaCl+2H2O 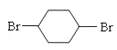 2NaOH
2NaOH +2NaBr 消去反应 ③⑤⑥
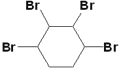
+2NaBr 消去反应 ③⑤⑥ 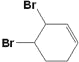 、
、
【解析】
苯和氯气在光照条件下发生取代生成氯苯,氯苯在醇强碱溶液中发生消去反应生成环己烯,环己烯和氯气发生加成反应生成1,2-二氯环己烷,1,2-二氯环己烷在醇强碱溶液中发生消去反应生成1,3-环己二烯,环己二烯与溴单质发生加成反应生成![]() ,
,![]() 与氢气发生加成反应生成
与氢气发生加成反应生成 ,
, 水解生成
水解生成![]() 。
。
⑴反应①是苯和氯气在光照条件下反应,化学方程式:![]() +Cl2
+Cl2![]()
![]() +HCl;
+HCl;
反应④是1,2-二氯环己烷在醇强碱溶液中发生消去反应生成1,3-环己二烯,其化学方程式![]() +2NaOH
+2NaOH  +2NaCl+2H2O;反应⑦是
+2NaCl+2H2O;反应⑦是 水解生成
水解生成![]() ,其化学方程式
,其化学方程式 +2NaOH
+2NaOH +2NaBr;
+2NaBr;
⑵七个反应类型分别是取代反应、消去反应、加成反应、消去反应、加成反应、加成反应、取代反应,故反应②为消去反应,属于加成反应的有③⑤⑥;
⑶反应发生加成反应,可能是1,2加成,也可能是1,2,3,4都加成,故答案为 、
、 。
。

练习册系列答案
相关题目