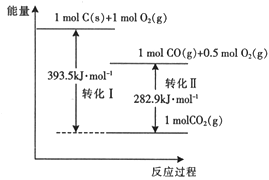
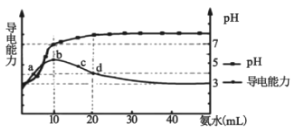
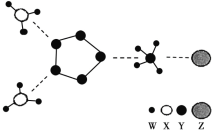
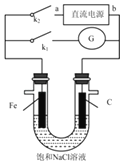
题目内容
【题目】在容积一定的密闭容器中,可逆反应:A2(g)+B2(g)![]() xC(g)符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是
xC(g)符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是

A.P3<P4,Y轴表示A2的转化率
B.P3>P4,Y轴表示A2的浓度
C.P3>P4,Y轴表示混合气体的密度
D.P3>P4,Y轴表示混合气体的平均摩尔质量
【答案】D
【解析】
由图Ⅰ可知,温度为T1时,根据到达平衡的时间可知P2>P1,且压强越大,C的含量越高,说明平衡向正反应方向移动,正反应为气体体积减小的反应;压强为P2时,根据到达平衡的时间可知T1>T2,且温度越高,C的含量越低,说明平衡向逆反应方向移动,则正反应为放热反应;
由图Ⅱ可知,y随温度的升高而降低,结合温度对平衡移动的影响判断y表示的物理量,结合压强对平衡移动的影响判断P3、P4的关系。
由图Ⅰ可知,温度为T1时,根据到达平衡的时间可知P2>P1,且压强越大,C的含量越高,说明平衡向正反应方向移动,正反应为气体体积减小的反应;压强为P2时,根据到达平衡的时间可知T1>T2,且温度越高,C的含量越低,说明平衡向逆反应方向移动,则正反应为放热反应;
A.P3<P4,在温度相同条件下,增大压强平衡向正反应移动,A2的转化率增大,同时升高温度平衡向逆反应移动,A2的转化率降低,图象与实际不符,故A错误;
B.P3>P4,在温度相同条件下,增大压强平衡向正反应移动,A2的浓度降低,同时升高温度平衡向逆反应移动,A2的浓度增大,图象与实际不符,故B错误;
C.P3>P4,在温度相同条件下,增大压强平衡向正反应移动,但混合气体的质量不变,容器的体积不变,密度不变。升高温度平衡向逆反应移动,但混合气体的质量不变,容器的体积不变,密度不变,图象与实际不相符,故C错误;
D.P3>P4,在相同温度下增大压强平衡向正反应方向移动,混合气体的总质量不变,总的物质的量减小,混合气的平均摩尔质量增大,升高温度,平衡向逆反应方向移动,混合气体总的物质的量增大,混合气的平均摩尔质量减小,图象与实际相符,故D正确;
故答案为D。

【题目】对于反应A(g)![]() 2B(g) H>0,在温度为T1和T2时,平衡体系中B的体积分数随压强变化的曲线如图所示。
2B(g) H>0,在温度为T1和T2时,平衡体系中B的体积分数随压强变化的曲线如图所示。

(1)根据曲线图,下列说法不正确的是___。
A.a、c两点的反应速率:c>a
B.b、c两点A气体的转化率相等
C.由状态b到状态a,可以通过加热的方法
D.由状态b到状态c,可以通过加压的方法
(2)若上述反应在定容密闭容器中进行,达到平衡状态的标志是___。
A.单位时间内生成nmolA的同时分解2nmolB B.两种气体的体积分数不再改变
C.混合气体的密度不再发生变化 D.混合气体的质量不再发生变化
(3)若上述反应达平衡时,B气体的平衡浓度为0.1mol·L-1,通过减小体积来增大体系的压强(温度保持不变),重新达平衡后,B气体的平衡浓度___0.1mol·L-1(填“大于”、“小于”或“等于”)。
(4)在100℃时,将0.40mol的B气体充入2L密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如表的数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(B)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(A)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
上表中n3___n4(填“大于”、“小于”或“等于”),反应A(g)![]() 2B(g)在100℃时的平衡常数K的值为___,升高温度后,反应2B(g)
2B(g)在100℃时的平衡常数K的值为___,升高温度后,反应2B(g)![]() A(g)的平衡常数K的值___(填“增大”、“减小”或“不变”)。
A(g)的平衡常数K的值___(填“增大”、“减小”或“不变”)。
【题目】用下图所示装置分别进行下列实验:将①中溶液滴入②中,按要求填写下列空格:

方案 | ①中物质 | ②中物质 | 填空编号及要求 |
实验1 | 滴加过酚酞的水 | Na2O2 | 写出会看到的现象①_____ |
实验2 | NaOH溶液 | 未打磨过的铝条 | 写出所发生反应的离子方程式 ②_____ |
实验3 | 盐酸 | NaAlO2溶液 | 画出生成沉淀量随盐酸的加入的变化图象 ③_____ |
实验4 | 稀盐酸 | Na2CO3与NaOH的混合溶液 | 已知生成气体量随盐酸的加入的变化图象如下,则原溶液中的Na2CO3与NaOH的物质的量浓度之比为 ④_____
|
实验5 | FeCl3和盐酸的混合液 | 等质量的铜、锌、铁三种金属的混合物 | 若反应后无固体剩余,则反应后的溶液中一定存在的阳离子是 ⑤_____ |