题目内容
5.硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的工艺流程如下: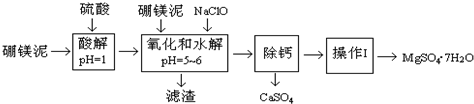
已知:NaClO与Mn2+反应产生MnO2沉淀.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
(1)实验中需用1.00mol/L的硫酸80.0mL,若用98%的浓硫酸来配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有烧杯、100mL容量瓶.
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有MnO2、SiO2.
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式:Mn2++ClO-+H2O=MnO2↓+2H++Cl-.
在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(4)为了检验滤液中Fe3+是否被除尽,可选用的试剂是A.
A.KSCN溶液 B.淀粉KI溶液 C.H2O2 D.KMnO4稀溶液
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(6)如果测得提供的硼镁泥的质量为100.0g,得到的MgSO4•7H2O196.8g,则MgSO4•7H2O的产率为80.0%(相对分子质量:MgSO4•7H2O-246 MgO-40).
分析 (1)依据配制一定物质的量浓度溶液的一般步骤选择合适的仪器;
(2)依据二氧化锰和二氧化硅不与稀硫酸反应解答;
(3)次氯酸根离子具有强的氧化性,能够氧化二价锰离子生成二氧化锰;亚铁离子具有还原性,能够被次氯酸钠氧化;
(4)三价铁离子遇到KSCN溶液显血红色;
(5)根据表中温度对硫酸镁、硫酸钙的影响完成;
(6)根据硼镁泥中MgO的质量分数(占40%),计算出生成MgSO4•7H2O质量及产率.
解答 解:(1)用98%的浓硫酸来配制1.00mol/L的硫酸80.0mL,应选择100ml容量瓶,一般步骤为:计算、量取、稀释、移液、洗涤、定容、摇匀等,用到的仪器有:量筒、胶头滴管、烧杯、玻璃棒、100ml容量瓶,
还需要的玻璃仪器:烧杯、100mL容量瓶;
故答案为:烧杯、100mL容量瓶;
(2)二氧化锰和二氧化硅不与稀硫酸反应,所以滤渣中还含有MnO2,SiO2;
故答案为:MnO2,SiO2;
(3)NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,反应的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-,溶液中含有Fe2+,具有还原性,可与NaClO发生氧化还原反应,反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,
故答案为:Mn2++ClO-+H2O═MnO2↓+2H++Cl-;2Fe2++ClO-+2H+═2Fe3++Cl-+H2O;
(4)三价铁离子遇到KSCN溶液显血红色,通常利用KSCN溶液检验三价铁离子的存在,故选:A;
(5)有温度对硫酸镁、硫酸钙的溶解度影响,温度越高,硫酸钙溶解度越小,可以采用蒸发浓缩,趁热过滤方法除去硫酸钙;
故答案为:蒸发浓缩,趁热过滤;
(6)100g硼镁泥中氧化镁的物质的量为:$\frac{100g×40%}{40g/mol}$=1mol,根据镁原子守恒,生成MgSO4•7H2O的物质的量为1mol,质量为246g/mol×1mol=246g,MgSO4•7H2O的产率为:$\frac{196.2g}{246g}$×100%=80.0%,
故答案为:80.0%.
点评 本题考查了从硼镁泥中提取MgSO4•7H2O的方法,涉及配制一定物质的量浓度的溶液的仪器选择、铁离子检验方法、物质分离的方法,产率计算等,侧重考查学生分析问题能力,题目难度较大.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | 常温常压下,2.24 L H2O中含有极性共价键的数目为0.2 NA | |
| B. | 0.1 mol•L-1 NH4Cl溶液中含有NH4+的数目小于0.1 NA | |
| C. | 100 mL 12 mol•L-1的浓HNO3与过量Cu反应转移电子的数目为0.6 NA | |
| D. | 标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2 NA |
| A. | 用活性炭去除冰箱中的异味 | |
| B. | 用热碱水清除炊具上残留的油污 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| D. | 用含硅胶、铁粉的透气小袋与食品一起密封包装 |
已知:Cu2S、CuS是两种不溶于水的黑色固体,在一定条件下都能与稀HNO3反应:
①3CuS+8H++8NO3-→3Cu2++3SO42-+8NO↑+4H2O
②3Cu2S+16H++10NO3-→6Cu2++3SO42-+10NO↑+8H2O
现将四份质量不同的某Cu2S和CuS混合物样品分别和100mL物质的量为5mol/L的稀硝酸充分反应,所取样品质量与产生气体体积.(标准状况测定)如表所示:
| 实验编号 | a | b | c |
| 样品质量(g) | 9.6 | 12.8 | 64.0 |
| 气体体积(L) | 5.04 | 6.72 | V |
(1)a实验结束后,溶液中c(NO3-)=2.75mol/L.
(2)b实验结束后,溶液的pH=0.
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>HBr>HI | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H2SO4 | D. | 熔点:SiO2>NaCl>CO2 |
| A. | 冰融化一一共价键 | B. | 氢氧化钠熔融--离子键、共价键 | ||
| C. | 氯化氢溶于水--范德华力 | D. | 硫酸氢钠溶于水--离子键、共价键 |
 某研究小组探究:
某研究小组探究: