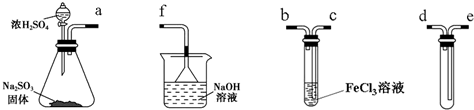
题目内容
19.K2FeO4是一种高效的多功能的水处理剂,工业上常采用NaClO氧化法生产,生产流程如下:
试回答下列问题:
(1)写出反应①的化学方程式并标明电子转移的方向和数目:
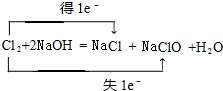 ;
;(2)完成“反应器”中反应的离子方程式:2Fe3++3ClO-+10OH-═2FeO42-+3Cl-+5H2O.
(3)转化过程中反应的化学方程式为:Na2FeO4+2KOH=K2FeO4+2NaOH;
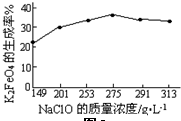
(4)某温度下,NaClO浓度与K2FeO4的生成率关系如图,当K2FeO4生成率最高时NaClO的物质的量浓度为3.7mol/L(结果保留两位有效数字)
(5)操作①的名称是过滤.在提纯产品过程中采用重结晶、过滤、用异丙醇洗涤、低温干燥的方法,其中,用异丙醇而不用水洗涤的原因是K2FeO4 在水溶液中易水解,选择异丙醇洗涤可以抑制K2FeO4水解.
分析 (1)(2)(3)向NaOH溶液中通入Cl2,发生的反应为Cl2+2NaOH=NaCl+NaClO+H2O,然后向溶液中加入Fe(NO3)3,发生的反应为3NaClO+2 Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O,向溶液中加入HCl来调节溶液的pH,然后过滤得到NaCl,向滤液中加入饱和KOH,利用溶解度不同,发生反应:Na2FeO4+2KOH=K2FeO4+2NaOH,过滤得到粗的K2FeO4,通过提纯得到纯的K2FeO4.
(4)由图可知,NaClO在275g/L时,K2FeO4的生成率最高,进而计算其物质的量浓度;
(5)K2FeO4 在水溶液中易水解,应选择非水溶液抑制K2FeO4水解,进行洗涤.
解答 解:向NaOH溶液中通入Cl2,发生的反应为Cl2+2NaOH=NaCl+NaClO+H2O,然后向溶液中加入Fe(NO3)3,发生的反应为3NaClO+2 Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O,向溶液中加入HCl来调节溶液的pH,然后过滤得到NaCl,向滤液中加入饱和KOH,利用溶解度不同,发生反应:Na2FeO4+2KOH=K2FeO4+2NaOH,过滤得到粗的K2FeO4,通过提纯得到纯的K2FeO4,
(1)反应①的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,标出电子转移数目与方向为: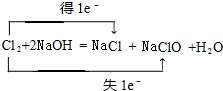 ,
,
故答案为: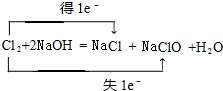 ;
;
(2)反应器中发生的反应为:3NaClO+2 Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O,离子方程式为:2Fe3++3ClO-+10OH-═2FeO42-+3Cl-+5H2O
故答案为:2;3;10;2;3;5;H2O;
(3)转化过程利用溶解度不同,由Na2FeO4转化为K2FeO4,反应方程式为:Na2FeO4+2KOH=K2FeO4+2NaOH,
故答案为:Na2FeO4+2KOH=K2FeO4+2NaOH;
(4)由图可知,NaClO在275g/L时,K2FeO4的生成率最高,NaClO的物质的量浓度为$\frac{\frac{275g}{74.5g/mol}}{1L}$=3.7mol/L,
故答案为:3.7mol/L,
(5)操作①是分离互不相溶的固体与液态,应采取过滤操作,K2FeO4 在水溶液中易水解,选择异丙醇洗涤可以抑制K2FeO4水解,
故答案为:过滤;K2FeO4 在水溶液中易水解,选择异丙醇洗涤可以抑制K2FeO4水解.
点评 本题考查学生对工艺流程的理解、对操作的评价分析、物质的分离提纯、氧化还原反应等,需要学生具有扎实的基础知识及灵活运用知识解决问题的能力,难度中等.

| A. | 32gO2所含的氧原子数目为NA | |
| B. | 标准状况下,22.4L水中所含的水分子数目为NA | |
| C. | 1mol•L-1Na2SO4溶液中含有的钠离子数目为2NA | |
| D. | 1molMg变为Mg2+时失去电子的数目为2NA |
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>HBr>HI | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H2SO4 | D. | 熔点:SiO2>NaCl>CO2 |
 运用所学化学原理,解决下列问题:
运用所学化学原理,解决下列问题:(1)氰化物多数易溶于水,有剧毒,其中HCN是易挥发的弱酸,已知:Ka(HCN)=6.17x10-10.处理含CN-废水时,用NaOH溶液调节至pH=9时(常温),c(CN-)<c(HCN)(填“>”、“<”或“=”).
(2)已知:
①C(s)+O2(g)═CO2(g);△H=a kJ•mol-1;
②CO2(g)+C(s)═2CO(g);△H=b kJ•mol-1;
③Si(s)+O2(g)═SiO2(s);△H=c kJ•mol-1.
工业上生产粗硅的热化学方程式为2C(s)+SiO2(s)═Si(s)+2CO(g)△H=(a+b-c)kJ•mol-1.
(3)已知:CO(g)+H2O(g)?H2(g)+CO2(g).下表为该反应在不同温度时的平衡常数.
| 温度/ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
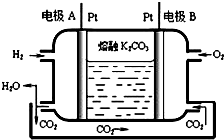
(7)一种新型氢氧燃料电池工作原理如图所示.写出电极A的电极反应式H2-2e-+CO32-═CO2+H2O.
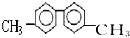
| A. | 该烃分子中最多有6个碳原子处于同一直线上 | |
| B. | 该烃分子中至少有10个碳原子处于同一平面上 | |
| C. | 该烃的一氯代物最多有四种 | |
| D. | 该烃是苯的同系物,能使酸性高锰酸钾溶液褪色 |
| A. | 铝、镁、钠、钾 | B. | 镁、铝、钾、钠 | C. | 钙、钾、铷、钠 | D. | 钙、钾、钠、锂 |
 某研究小组探究:
某研究小组探究: