题目内容
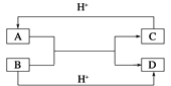
【题目】图中的原电池可以测定AgCl的沉淀溶解平衡常数。有关该原电池的说法不正确的是
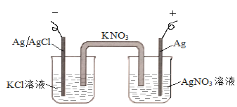
A.负极的电极反应式为:Ag+Cl--e-=AgCl
B.正极的电极反应式是Ag++ e-=Ag
C.电池总反应不是氧化还原反应,不能组成原电池
D.反应时,盐桥中的K+移向AgNO3溶液,NO3-移向KCl溶液
【答案】C
【解析】
左边为负极,电极反应式为:Ag+Cl--e-═AgCl,右边Ag为正极,正极发生还原反应,电极反应式是Ag++e-═Ag,总反应为:Ag++Cl-═AgCl。
A、装置图中,左边为负极,电极反应式为:Ag+Cl--e-═AgCl,A正确,不符合题意;
B、右边Ag为正极,正极发生还原反应,电极反应式是Ag++e-═Ag,B正确,不符合题意;
C、该原电池的总反应为:Ag++Cl-═AgCl,不是氧化还原反应,也能组成原电池,C错误,符合题意;
D、原电池工作时,阳离子向正极移动,阴离子向负极移动,所以盐桥中的K+移向正极AgNO3溶液,NO3-移向负极KCl溶液,D正确,不符合题意;
答案选C。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 相同温度下,同时向 ①4 mL 0.1 molL-1 KMnO4酸性溶液和②4 mL 0.2 molL-1 KMnO4酸性溶液中,分别加入4 mL 1 molL-1 H2C2O4溶液 | ①中溶液先褪色 | 该实验条件下,KMnO4浓度越小,反应速率越快 |
B | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
C | 加热2NO2(g) | 颜色加深 | 证明正反应是放热反应 |
D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH | 后者较大 | 证明非金属性 S>C |
A.AB.BC.CD.D