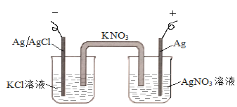
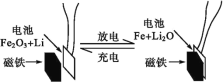
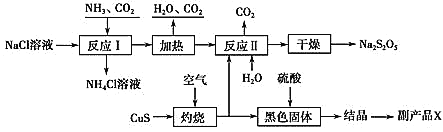
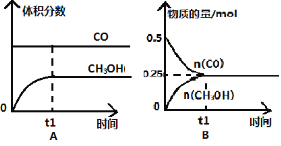
题目内容
【题目】汽车常用蓄电池其结构如图所示,放电时反应如下: PbO2+Pb+2H2SO4=2PbSO4+2H2O。根据此反应判断,下列叙述中不正确的是
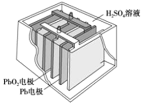
A.Pb 作为负极,失去电子,被氧化
B.电池放电时,溶液酸性增强
C.负极反应是 Pb+SO42-–2e-=PbSO4
D.PbO2 得电子,被还原
【答案】B
【解析】
放电时的电池反应PbO2+Pb+2H2SO4═2PbSO4+2H2O可知,Pb在反应中失去电子,发生氧化反应,为电池的负极,电极反应式为Pb+SO42--2e-═PbSO4,PbO2在放电过程中得到电子、被还原,是原电池的正极;根据总反应可知,原电池放电的过程中消耗硫酸,所以溶液的酸性减弱。
A.原电池中负极失去电子、发生氧化反应,根据电池放电时的反应:PbO2+Pb+2H2SO4═2PbSO4+2H2O可知,负极Pb失去电子,即Pb为负极,PbO2为正极,故A正确;
B.由于原电池放电的过程中消耗硫酸,电解质溶液中氢离子浓度逐渐减小,所以溶液的酸性减弱,故B错误;
C.原电池中,Pb在反应中失去电子生成PbSO4,为负极,电极反应式为Pb+SO42--2e-═PbSO4,故C正确;
D.PbO2在放电过程中化合价降低,得到电子被还原,所以PbO2为原电池的正极、反应中被还原,故D正确;
故选B。

练习册系列答案
相关题目