题目内容
9.工业上从废铅蓄电池的铅膏回收铅的过程中,可用碳酸盐溶液与处理后的铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32-(aq)═PbCO3(s)+SO42-(aq).某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.(1)上述反应的平衡常数表达式:K=$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$
(2)室温时,向两份相同的PbSO4样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化.在Na2CO3溶液中PbSO4转化率较大,理由是相同浓度的Na2CO3和NaHCO3溶液中,前者c(CO32-)较大
(3)查阅文献:上述反应还可能生成碱式碳酸铅[2PbCO3•Pb(OH)2],它和PbCO3受热都易分解生成PbO.该课题组对固体产物(不考虑PbSO4)的成分提出如下假设.请你完成假设二和假设三:
假设一:全部为PbCO3;
假设二:全部为2PbCO3•Pb(OH)2;
假设三:PbCO3与2PbCO3•Pb(OH)2的混合物.
(4)为验证假设一是否成立,课题组进行如下研究:
①定性研究:请你完成表中内容
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取一定量样品充分干燥,然后将样品加热分解,将产生的气体依次通过盛有无水硫酸铜的干燥管和盛有澄清石灰水的烧瓶 | 若无水硫酸铜不变蓝色,澄清石灰水变浑浊,说明样品全部是PbCO3 |
分析 (1)PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq).依据平衡常数概念写出计算式;
(2)根据反应达到的平衡分析:PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq),增大碳酸根离子浓度平衡正向进行,促进硫酸铅转化;
(3)依据题干信息可知,PbSO4转在转化时能生成碳酸铅,也能生成碱式碳酸铅;
(4)依据碳酸铅分解生成PbO,CO2,碱式碳酸铅分解生成PbO、CO2、H2O,生成的产物不同设计实验进行验证,有水生成移动不是碳酸铅;
解答 解:(1)反应平衡常数是用各反应物和生成物浓度计算表示,固体和纯液体的浓度是定值不出现在表达式中,平衡常数K=$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$,故答案为:$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$;
(2)在溶液中Na2CO3能完全电离生成碳酸根离子,而碳酸氢根离子微弱电离生成碳酸根离子,所以相同浓度的Na2CO3和NaHCO3溶液中,碳酸钠溶液中碳酸根离子浓度大,PbSO4转化率较大;
故答案为:Na2CO3;相同浓度的Na2CO3和NaHCO3溶液中,前者c(CO32-)较大;
(3)依据题干信息可知,PbSO4转在转化时能生成碳酸铅,也能生成碱式碳酸铅,故所得产物有三种可能情况:一是全部为碳酸铅,二是全部为碱式碳酸铅,三是两者都有;
故答案为:全部为2PbCO3•Pb(OH)2;PbCO3与2PbCO3•Pb(OH)2的混合物;
(4)①因为碳酸铅分解生成PbO,CO2,碱式碳酸铅分解生成PbO、CO2、H2O,故只要分析产物中是否有水生成就可以判断假设一是否成立;
故答案为:
| 实验步骤 | 预期的实验现象和结论 |
| 取一定量样品充分干燥,然后将样品加热分解,将产生的气体依次通过盛有无水硫酸铜的干燥管和盛有澄清石灰水的烧瓶 | 若无水硫酸铜不变蓝色,澄清石灰水变浑浊,说明样品全部是PbCO3 |
故答案为:同意,若全部为PbCO3,26.7g完全分解后,其固体质量为22.3g.
点评 本题以沉淀溶解平衡为切入点考查了平衡移动原理以及分析图象和数据处理能力,实验设计方案的思路和实验步骤,难度较大.

 、-COOH 4种基团两两组合而成的有机物中,能跟NaOH溶液发生化学反应的有( )
、-COOH 4种基团两两组合而成的有机物中,能跟NaOH溶液发生化学反应的有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | N2、H2、NH3的物质的量不再改变 | |
| B. | c(N2):c(H2):c(NH3)=1:2:3 | |
| C. | N2与H2物质的量之和是NH3的2倍 | |
| D. | 单位时间里每增加1mol N2,同时增加3mol H2 |
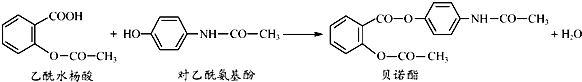
下列有关叙述正确的是( )
| A. | 贝诺酯分子中有三种含氧官能团 | |
| B. | 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应 | |
| C. | 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| D. | 贝诺酯与足量NaOH溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |
| A. | 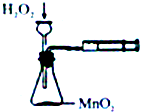 定量测定化学反应速率 | B. | 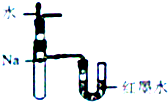 验证Na和水反应的热效应 | ||
| C. |  比较KMnO4、cl2、S的氧化性 | D. | 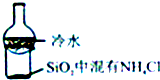 加热烧杯,分离SiO2和NH4Cl |
| A. | 加催化剂,v正、v逆都发生变化,且变化的倍数相等 | |
| B. | 加压,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数 | |
| C. | 降温,v正、v逆减小,且v正减小的倍数大于v逆减小的倍数 | |
| D. | 体积不变,加入氩气,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数 |
 和
和 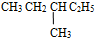 ⑤
⑤ 和
和
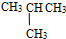 ⑦C2H5OH和C4H9OH
⑦C2H5OH和C4H9OH