题目内容
某氯化镁溶液的密度为1.2g?cm-3,其中镁离子的质量分数为5.1%,300mL该溶液中Cl-离子的物质的量浓度约等于
- A.0.77mol?L-1
- B.1.55mol?L-1
- C.2.55mol?L-1
- D.5.1mol?L-1
D
分析:根据镁离子的质量分数计算氯化镁的质量分数,进而根据c=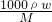 计算氯化镁的物质的量浓度,根据化学式的组成计算Cl-离子的物质的量浓度.
计算氯化镁的物质的量浓度,根据化学式的组成计算Cl-离子的物质的量浓度.
解答:MaCl2中Mg的质量分数为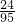 ,
,
溶液中镁离子的质量分数为5.1%,
则溶液中氯化镁的质量分数为: =20.2%
=20.2%
溶液中氯化镁的物质的量浓度为:c=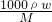 =
=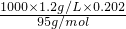 =2.55mol/L,
=2.55mol/L,
则c(Cl-)=2c(MaCl2)=2×2.55mol/L=5.1mol/L,
故选D.
点评:本题考查物质的量浓度的计算,题目难度不大,注意根据镁离子的质量分数计算氯化镁的质量分数,进而根据c=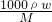 计算氯化镁的物质的量浓度.
计算氯化镁的物质的量浓度.
分析:根据镁离子的质量分数计算氯化镁的质量分数,进而根据c=
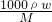 计算氯化镁的物质的量浓度,根据化学式的组成计算Cl-离子的物质的量浓度.
计算氯化镁的物质的量浓度,根据化学式的组成计算Cl-离子的物质的量浓度.解答:MaCl2中Mg的质量分数为
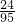 ,
,溶液中镁离子的质量分数为5.1%,
则溶液中氯化镁的质量分数为:
 =20.2%
=20.2%溶液中氯化镁的物质的量浓度为:c=
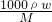 =
=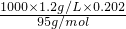 =2.55mol/L,
=2.55mol/L,则c(Cl-)=2c(MaCl2)=2×2.55mol/L=5.1mol/L,
故选D.
点评:本题考查物质的量浓度的计算,题目难度不大,注意根据镁离子的质量分数计算氯化镁的质量分数,进而根据c=
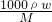 计算氯化镁的物质的量浓度.
计算氯化镁的物质的量浓度. 
练习册系列答案
相关题目
某氯化镁溶液的密度为1.18g/cm3,其中镁离子的质量分数为5.6%,300mL该溶液中Cl-的物质的量约等于( )
| A、0.37m01 | B、0.56mol | C、0.83mol | D、1.65mol |