题目内容
(2009?开封一模)某氯化镁溶液的密度为1.18g?cm-3,其中镁离子的质量分数为5.1%,500mL该溶液中Cl-的物质的量浓度约等于( )
分析:根据镁离子的质量分数计算氯化镁的质量分数,进而根据c=
计算氯化镁的物质的量浓度,根据化学式的组成可知溶液中c(Cl-)=2c(MgCl2).
| 1000ρw |
| M |
解答:解:MgCl2中Mg离子的质量分数为
,溶液中镁离子的质量分数为5.1%,
则溶液中氯化镁的质量分数为:
=20.2%,
溶液中氯化镁的物质的量浓度为:c=
mol/L≈2.5mol/L,
则c(Cl-)=2c(MaCl2)=2×2.5mol/L=5mol/L,
故选A.
| 24 |
| 95 |
则溶液中氯化镁的质量分数为:
| 5.1% | ||
|
溶液中氯化镁的物质的量浓度为:c=
| 1000×1.18×20.2% |
| 95 |
则c(Cl-)=2c(MaCl2)=2×2.5mol/L=5mol/L,
故选A.
点评:本题考查物质的量浓度的计算,难度不大,注意掌握物质的量浓度与质量分数的关系,可以根据定义式计算计算,注意公式的灵活运用.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目

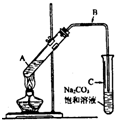 (2009?成都一模)某兴趣小组利用如图装置,取不同浓度的硫酸与 3mL 无水乙醇和 2mL 冰醋酸分别进行制取乙酸乙酯的研究.
(2009?成都一模)某兴趣小组利用如图装置,取不同浓度的硫酸与 3mL 无水乙醇和 2mL 冰醋酸分别进行制取乙酸乙酯的研究. CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O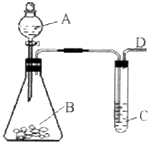 (2009?福州一模)某同学用如图所示的装置来探究SO2的性质及有关实验.
(2009?福州一模)某同学用如图所示的装置来探究SO2的性质及有关实验.