题目内容
【题目】铬是一种银白色金属,化学性质稳定,在化合物中常见+2、+3和+6价等价态。工业上以铬铁矿(主要成分为FeO·Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠Na2Cr2O7·2H2O(已知Na2Cr2O7是一种强氧化剂),其主要工艺流程如下:

查阅资料得知:常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO72-。回答下列问题:
(1)滤渣D的化学式为________,溶液A中加入过量H2O2的离子方程式是_____________。
(2)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝热反应制取金属铬的化学方程式_______________。
(3)酸化滤液D时,不选用盐酸的原因是_____________。
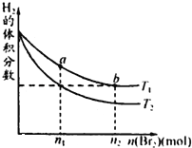
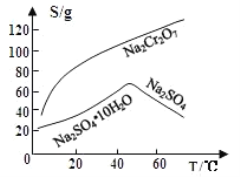
(4)固体E的主要成分是Na2SO4,根据如图分析操作a为蒸发浓缩、__________、洗涤、干燥。
(5)已知含+6价铬的污水会污染环境,某电镀厂废水中往往含有一定量的Cr2O72-,可用下列方法进行处理。(已知Cr2O72-的浓度为1.0×10-3 mol /L)
方法一:电解法——向废水(酸性)中通入直流电,在阴极上,+6价的铬变为低毒的+3价。
①写出该阴极的电极反应_____________________。
方法二:某研究性学习小组为了变废为宝,在废水中加入绿矾(FeSO4·7H2O)处理得到磁性材料 CrFe2O4(Cr的化合价为+3,Fe的化合价为+3、+2)。
②欲使1 m3该废水中的Cr2O72-完全转化为CrFe2O4 ,理论上需要加入________g绿矾 。(已知FeSO4·7H2O摩尔质量为278g/mol)
【答案】Al(OH)3 H2O2 + 2Fe2++2H+ == 2Fe3++2H2O Cr2O3+2Al ![]() Al2O3+2Cr Cr2O72-会氧化Cl生成氯气,造成污染 趁热过滤 Cr2O72-+6e+14 H+ == 2 Cr3++7 H2O 1112
Al2O3+2Cr Cr2O72-会氧化Cl生成氯气,造成污染 趁热过滤 Cr2O72-+6e+14 H+ == 2 Cr3++7 H2O 1112
【解析】
铬铁矿酸浸时,SiO2不溶,则固体A为SiO2;则溶液A中含有Cr3+、Fe2+、Al3+、H+和SO42-;加入过量的H2O2时,Fe2+变为Fe3+;调节pH使Fe3+变为Fe(OH)3;溶液C中加入过量的NaBiO3和适量的NaOH,生成氢氧化铝沉淀;NaBiO3在碱性条件下,能将Cr3+转化为CrO72-。
(1)滤渣D为氢氧化铝,化学式为Al(OH)3;溶液A中的Fe2+具有还原性,与H2O2反应生成水和Fe3+,离子方程式为H2O2 + 2Fe2++2H+ == 2Fe3++2H2O;
(2)铝与Cr2O3发生铝热反应制取金属铬和氧化铝,方程式为Cr2O3+2Al ![]() Al2O3+2Cr;
Al2O3+2Cr;
(3)酸化滤液D时,溶液中的Cr2O72-具有强氧化性,能氧化Cl生成氯气,造成污染;
(4)根据图像,硫酸钠固体析出时,温度高于45℃,此温度时重铬酸钠溶解度较大,则采用蒸发浓缩,趁热过滤的方法分离;
(5)①阴极Cr2O72-得电子,与氢离子反应生成Cr3+和水,电极反应式为Cr2O72-+6e+14 H+ == 2 Cr3++7 H2O;
②根据题意可知,CrFe2O4中含有一个Cr3+、2个Fe,则Cr2O72-~4 FeSO4,1.0×10-3 mol /L×103 L=1mol,m(FeSO4·7H2O)=4mol×278g/mol=1112g。